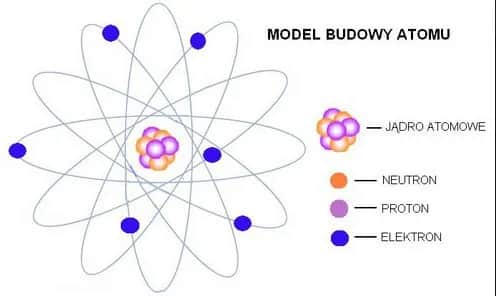
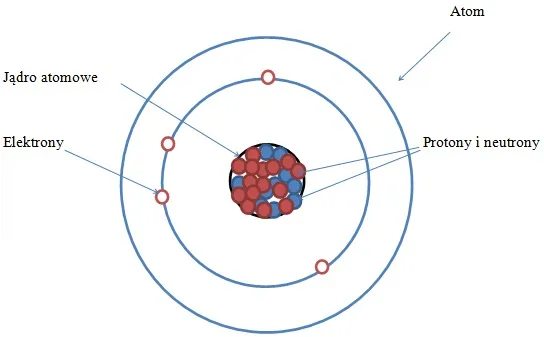
Atom to podstawowy budulec materii, który składa się z jądra atomowego oraz chmury elektronowej. Jądro, znajdujące się w centrum atomu, zawiera protony i neutrony, podczas gdy elektrony krążą wokół niego na różnych poziomach energetycznych. To właśnie te składniki decydują o właściwościach każdego pierwiastka.
Zrozumienie budowy atomu jest kluczowe, aby poznać, jak działa otaczający nas świat. W tym artykule w prosty sposób wyjaśniamy, z czego składa się atom, jakie są role jego poszczególnych części oraz jak wpływają one na zachowanie materii. Dzięki temu dowiesz się, dlaczego atomy są tak ważne w nauce i codziennym życiu. Kluczowe informacje:- Atom składa się z jądra atomowego (protony i neutrony) oraz chmury elektronowej (elektrony).
- Protony mają ładunek dodatni, neutrony są obojętne, a elektrony – ujemne.
- Jądro atomowe jest centralną częścią atomu, a elektrony krążą wokół niego na różnych poziomach energetycznych.
- To właśnie protony, neutrony i elektrony decydują o właściwościach chemicznych i fizycznych pierwiastków.
- Zrozumienie budowy atomu jest podstawą do nauki chemii i fizyki.
Czym jest atom i jak wygląda jego budowa?
Atom to najmniejsza jednostka materii, która zachowuje właściwości chemiczne pierwiastka. Składa się z jądra atomowego oraz chmury elektronowej, które razem tworzą jego strukturę. To właśnie te elementy decydują o tym, jak zachowuje się każdy pierwiastek.
Jądro atomowe znajduje się w centrum atomu i jest otoczone przez elektrony krążące wokół niego. Cała budowa atomu przypomina miniaturowy układ słoneczny, gdzie jądro pełni rolę słońca, a elektrony – planet. Zrozumienie, z czego jest zbudowany atom, to klucz do poznania podstaw chemii i fizyki.
Jądro atomowe: serce atomu i jego składniki
Jądro atomowe to centralna część atomu, która skupia większość jego masy. Składa się z dwóch głównych składników: protonów i neutronów. Protony mają dodatni ładunek elektryczny, natomiast neutrony są obojętne elektrycznie.
To właśnie jądro atomowe decyduje o tożsamości pierwiastka. Liczba protonów w jądrze określa, z jakim pierwiastkiem mamy do czynienia. Neutrony natomiast stabilizują jądro, zapobiegając odpychaniu się protonów. Bez nich atom nie mógłby istnieć w stabilnej formie.
Protony i neutrony: różnice i ich rola w atomie
Protony to dodatnio naładowane cząstki, które znajdują się w jądrze atomowym. Ich liczba decyduje o liczbie atomowej pierwiastka, czyli jego pozycji w układzie okresowym. Każdy proton ma ładunek +1, co wpływa na ogólny ładunek jądra.
Neutrony, w przeciwieństwie do protonów, nie mają ładunku elektrycznego. Ich główną rolą jest utrzymywanie stabilności jądra. Neutrony i protony mają podobną masę, ale to neutrony zapobiegają odpychaniu się protonów dzięki sile jądrowej.
| Składnik | Ładunek | Masa | Lokalizacja |
| Proton | +1 | 1,67 × 10⁻²⁷ kg | Jądro atomowe |
| Neutron | 0 | 1,67 × 10⁻²⁷ kg | Jądro atomowe |
Czytaj więcej: Jak obliczyć masę atomu – proste metody i przykłady obliczeń
Chmura elektronowa: jak elektrony wpływają na atom?
Chmura elektronowa to obszar wokół jądra atomowego, w którym poruszają się elektrony. W przeciwieństwie do jądra, elektrony nie mają stałej pozycji, lecz tworzą „chmurę” prawdopodobieństwa. To właśnie elektrony decydują o reaktywności chemicznej atomu.
Elektrony mają ładunek ujemny, co sprawia, że są przyciągane przez dodatnio naładowane jądro. Ich ruch wokół jądra jest nieprzewidywalny, ale można określić prawdopodobieństwo ich występowania w danym obszarze. To właśnie z czego jest zbudowany atom wpływa na jego zachowanie w reakcjach chemicznych.
Poziomy energetyczne: gdzie znajdują się elektrony?
Elektrony nie krążą chaotycznie, lecz poruszają się na określonych poziomach energetycznych. Każdy poziom ma inną energię, a elektrony zajmują te o najniższej dostępnej energii. Im dalej od jądra, tym wyższy poziom energetyczny.
Elektrony mogą przeskakiwać między poziomami, pochłaniając lub emitując energię. To zjawisko jest kluczowe dla zrozumienia, jak atomy absorbują i emitują światło. Bez poziomów energetycznych nie byłoby możliwe istnienie widm atomowych.
Jak składniki atomu wpływają na jego właściwości?
 Właściwości atomu zależą od liczby protonów, neutronów i elektronów. Protony decydują o liczbie atomowej pierwiastka, neutrony stabilizują jądro, a elektrony wpływają na reaktywność chemiczną. Razem tworzą unikalny „charakter” każdego atomu.
Właściwości atomu zależą od liczby protonów, neutronów i elektronów. Protony decydują o liczbie atomowej pierwiastka, neutrony stabilizują jądro, a elektrony wpływają na reaktywność chemiczną. Razem tworzą unikalny „charakter” każdego atomu.
Na przykład, atomy z tą samą liczbą protonów, ale różną liczbą neutronów to izotopy. Z kolei atomy z różną liczbą elektronów to jony. Zrozumienie, z czego jest zbudowany atom, pozwala przewidzieć jego zachowanie w różnych warunkach.
- Protony: decydują o liczbie atomowej i tożsamości pierwiastka.
- Neutrony: stabilizują jądro i tworzą izotopy.
- Elektrony: wpływają na reaktywność chemiczną i tworzą wiązania.
Jak budowa atomu decyduje o jego zachowaniu?
W artykule wyjaśniliśmy, że atom składa się z jądra atomowego i chmury elektronowej, które razem wpływają na jego właściwości. Jądro, zawierające protony i neutrony, decyduje o tożsamości pierwiastka, podczas gdy elektrony, poruszające się wokół jądra, odpowiadają za reaktywność chemiczną. To właśnie te składniki sprawiają, że każdy atom ma unikalne cechy.
Przykładem są izotopy, które mają tę samą liczbę protonów, ale różną liczbę neutronów, oraz jony, które różnią się liczbą elektronów. Te różnice wpływają na stabilność atomu i jego zdolność do tworzenia wiązań chemicznych. Zrozumienie, z czego jest zbudowany atom, pozwala nam przewidzieć, jak będzie się zachowywał w różnych reakcjach.
Podsumowując, budowa atomu jest kluczem do zrozumienia materii. Protony, neutrony i elektrony nie tylko definiują pierwiastek, ale także decydują o jego właściwościach fizycznych i chemicznych. To właśnie dlatego nauka o atomach jest podstawą chemii, fizyki i biologii.