Dlaczego atom jest elektrycznie obojętny? To pytanie często pojawia się w kontekście nauk przyrodniczych, a odpowiedź kryje się w jego budowie i równowadze ładunków. Atom składa się z protonów, neutronów i elektronów, ale to właśnie protony i elektrony odgrywają kluczową rolę w jego obojętności elektrycznej. Protony, znajdujące się w jądrze atomu, mają ładunek dodatni, podczas gdy elektrony krążące wokół jądra są naładowane ujemnie. Gdy liczba protonów i elektronów jest równa, wypadkowy ładunek atomu wynosi zero, co sprawia, że jest on elektrycznie obojętny. W tym artykule wyjaśnimy, jak działa ta równowaga i dlaczego jest tak ważna. Kluczowe wnioski:
- Atom jest elektrycznie obojętny, ponieważ zawiera równą liczbę protonów i elektronów.
- Protony mają ładunek dodatni, a elektrony – ujemny, co prowadzi do równowagi ładunków.
- Wypadkowy ładunek atomu wynosi zero, co sprawia, że jest on obojętny elektrycznie.
- Wyjątkiem od tej reguły są jony, które powstają, gdy atom traci lub zyskuje elektrony.
- Równowaga ładunków jest kluczowa dla stabilności materii i zachodzenia reakcji chemicznych.
Czym jest elektryczna obojętność atomu?
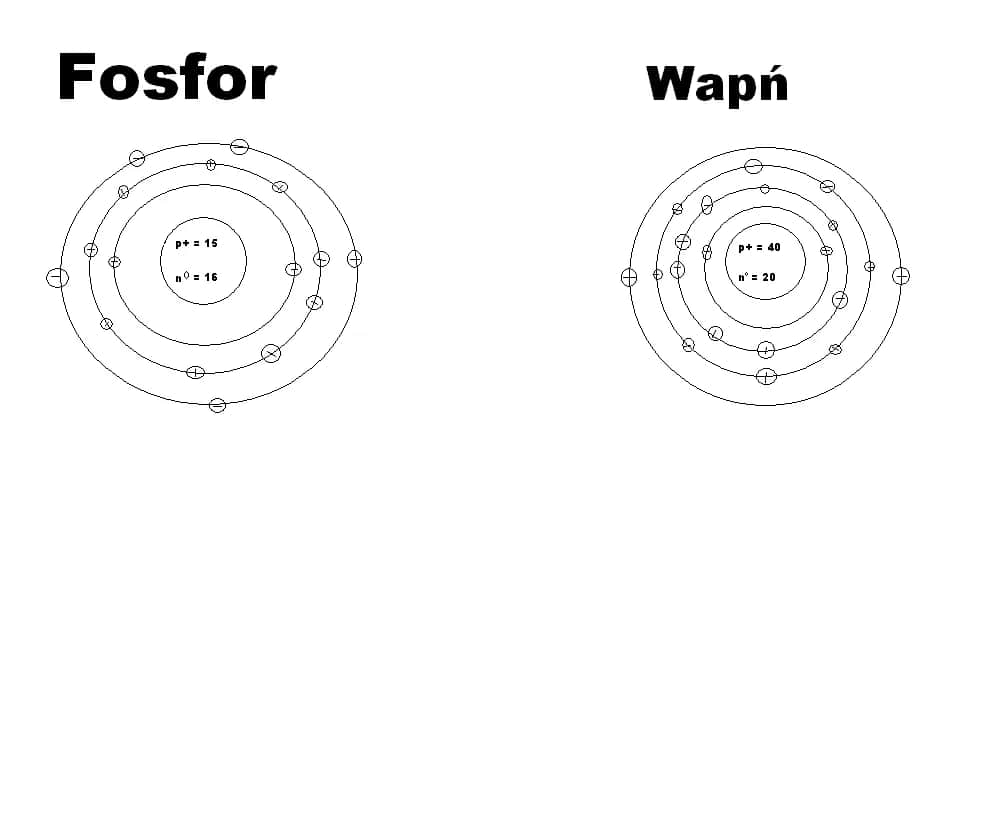
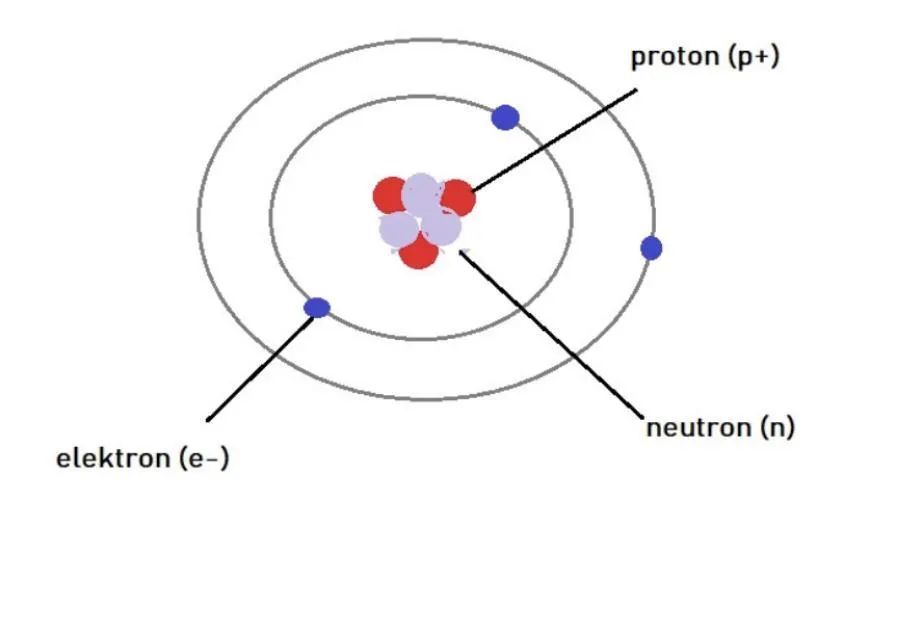
Elektryczna obojętność atomu to stan, w którym atom nie wykazuje żadnego wypadkowego ładunku elektrycznego. Dzieje się tak, ponieważ liczba protonów (cząstek naładowanych dodatnio) jest równa liczbie elektronów (cząstek naładowanych ujemnie). Ta równowaga sprawia, że atom pozostaje stabilny i neutralny.
Dlaczego to takie ważne? Bez obojętności elektrycznej atomy nie mogłyby tworzyć stabilnych cząsteczek ani wchodzić w reakcje chemiczne. To właśnie ta równowaga ładunków pozwala na istnienie materii w formie, jaką znamy. Dlaczego atom jest elektrycznie obojętny? Odpowiedź tkwi w jego budowie.
Jak protony i elektrony wpływają na ładunek atomu?
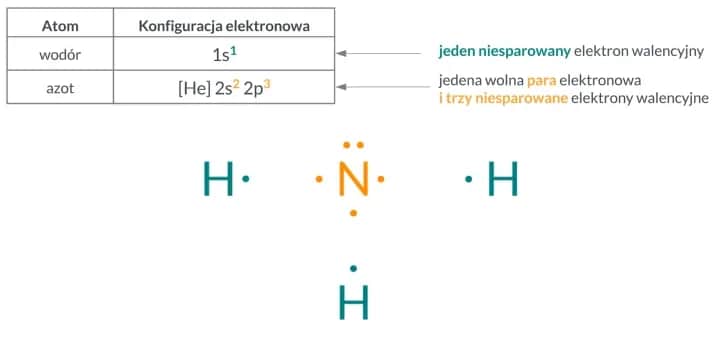
Protony i elektrony to dwa rodzaje cząstek, które decydują o ładunku atomu. Protony, znajdujące się w jądrze atomu, mają ładunek dodatni. Elektrony, krążące wokół jądra, są naładowane ujemnie. Gdy ich liczby są równe, ładunki się znoszą, a atom staje się obojętny.
Neutrony, również obecne w jądrze, nie wpływają na ładunek atomu, ponieważ są elektrycznie neutralne. To właśnie protony i elektrony odgrywają kluczową rolę w utrzymaniu elektrycznej obojętności. Poniższa tabela porównuje ich właściwości:
| Cząstka | Ładunek | Masa | Lokalizacja |
| Proton | +1 | 1,67 × 10⁻²⁷ kg | Jądro atomowe |
| Elektron | -1 | 9,11 × 10⁻³¹ kg | Chmura elektronowa |
Równowaga ładunków w atomie – klucz do obojętności
Równowaga ładunków w atomie przypomina bilans na koncie bankowym. Jeśli wpływy (protony) i wydatki (elektrony) są równe, saldo (ładunek atomu) wynosi zero. To właśnie dlatego atom jest elektrycznie obojętny.
Jeśli jednak atom straci lub zyska elektrony, ta równowaga zostaje zaburzona. Wtedy atom staje się jonem – naładowanym dodatnio lub ujemnie. Ale w normalnych warunkach, gdy liczba protonów i elektronów jest równa, atom pozostaje neutralny.
Czytaj więcej: Jak wygląda atom? Odkryj jego niezwykłą budowę i strukturę
Dlaczego atom nie zawsze jest obojętny? Wyjątki od reguły
Choć większość atomów jest elektrycznie obojętna, istnieją wyjątki od tej reguły. Gdy atom traci lub zyskuje elektrony, staje się jonem – naładowanym dodatnio lub ujemnie. To właśnie jony są odpowiedzialne za wiele zjawisk chemicznych i fizycznych w przyrodzie.
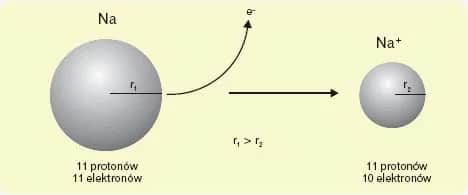
Na przykład, gdy atom sodu traci jeden elektron, staje się jonem Na+. Z kolei atom chloru, który zyskuje elektron, przekształca się w jon Cl-. Te zmiany w liczbie elektronów zaburzają elektryczną obojętność atomu. Oto kilka powszechnych jonów:
- Na+ (jon sodu)
- Cl- (jon chloru)
- Ca²+ (jon wapnia)
- O²- (jon tlenu)
Jak powstają jony i co zmieniają w atomie?
Jony powstają, gdy atom oddaje lub przyjmuje elektrony. Proces ten często zachodzi podczas reakcji chemicznych. Na przykład, w soli kuchennej (NaCl) atom sodu oddaje elektron, a atom chloru go przyjmuje. W efekcie powstają jony Na+ i Cl-, które przyciągają się wzajemnie.
Zmiana liczby elektronów wpływa na właściwości atomu. Jon Na+ ma mniejszy rozmiar niż neutralny atom sodu, ponieważ traci zewnętrzną powłokę elektronową. Z kolei jon Cl- jest większy niż neutralny atom chloru, ponieważ zyskuje dodatkowy elektron.
Proste przykłady obojętności atomu w życiu codziennym
 Elektryczna obojętność atomów jest wszechobecna w naszym otoczeniu. Woda (H₂O) to doskonały przykład – każda cząsteczka wody składa się z dwóch atomów wodoru i jednego atomu tlenu, które są elektrycznie obojętne. Dzięki temu woda może pełnić funkcję uniwersalnego rozpuszczalnika.
Elektryczna obojętność atomów jest wszechobecna w naszym otoczeniu. Woda (H₂O) to doskonały przykład – każda cząsteczka wody składa się z dwóch atomów wodoru i jednego atomu tlenu, które są elektrycznie obojętne. Dzięki temu woda może pełnić funkcję uniwersalnego rozpuszczalnika.
Innym przykładem jest powietrze, które zawiera głównie azot (N₂) i tlen (O₂). Oba te gazy składają się z obojętnych atomów, co sprawia, że powietrze nie przewodzi prądu elektrycznego. To właśnie elektryczna obojętność atomów pozwala nam bezpiecznie oddychać i korzystać z wody.
Jak jony wpływają na właściwości materii?
W artykule dowiedzieliśmy się, że elektryczna obojętność atomów jest kluczowa dla stabilności materii, ale istnieją wyjątki od tej reguły. Jony, takie jak Na+ czy Cl-, powstają, gdy atom traci lub zyskuje elektrony, co zmienia jego ładunek i właściwości. Na przykład, jon sodu (Na+) jest mniejszy niż neutralny atom sodu, a jon chloru (Cl-) – większy niż neutralny atom chloru.
Te zmiany mają ogromne znaczenie w przyrodzie i życiu codziennym. Przykładem jest sól kuchenna (NaCl), która składa się z jonów Na+ i Cl-. Dzięki ich wzajemnemu przyciąganiu sól ma stabilną strukturę krystaliczną. Z kolei woda, złożona z obojętnych atomów, może pełnić funkcję uniwersalnego rozpuszczalnika, co jest możliwe właśnie dzięki elektrycznej obojętności jej cząsteczek.
Podsumowując, zarówno obojętne atomy, jak i jony odgrywają kluczową rolę w kształtowaniu właściwości materii. Bez nich nie istniałyby podstawowe substancje, takie jak woda czy sól, które są niezbędne dla życia i funkcjonowania świata.