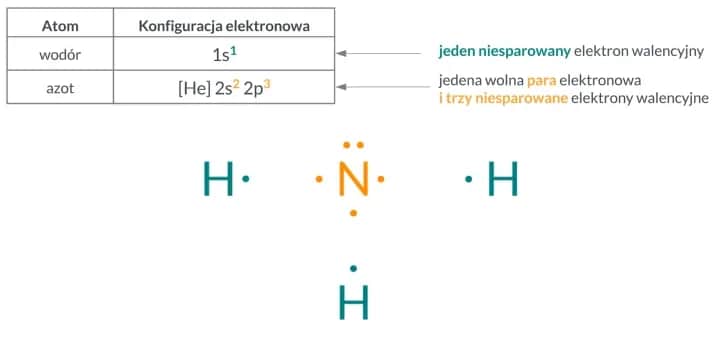
Obliczanie masy atomu to kluczowy element chemii, który pozwala zrozumieć właściwości różnych pierwiastków. Masa atomu jest definiowana jako suma liczby protonów i neutronów w jądrze atomowym. Jest to istotne, ponieważ masa atomowa wpływa na zachowanie atomów w reakcjach chemicznych oraz na ich interakcje z innymi atomami.
W praktyce, masa atomowa jest wyrażana w jednostkach masy atomowej (u), gdzie jedna jednostka odpowiada 1/12 masy izotopu węgla-12. W obliczeniach nie uwzględnia się elektronów, ponieważ ich masa jest znikoma w porównaniu do protonów i neutronów. Zrozumienie, jak obliczyć masę atomu, jest nie tylko interesujące, ale również niezwykle przydatne w naukach przyrodniczych.
Kluczowe informacje:- Masa atomu to suma liczby protonów i neutronów w jądrze atomowym.
- Jednostka masy atomowej (u) jest zdefiniowana jako 1/12 masy izotopu węgla-12.
- Protony i neutrony mają znaczący wpływ na masę atomową, podczas gdy elektrony są pomijane w obliczeniach.
- Zrozumienie masy atomu jest kluczowe dla analizy reakcji chemicznych.
- Obliczanie masy atomu pomaga w identyfikacji i klasyfikacji pierwiastków chemicznych.
Jak obliczyć masę atomu – krok po kroku do zrozumienia metody
Obliczanie masy atomu to kluczowa umiejętność w chemii, która pozwala zrozumieć właściwości różnych pierwiastków. Warto wiedzieć, że masa atomowa jest sumą liczby protonów i neutronów w jądrze atomowym. Ten proces jest istotny, ponieważ wpływa na zachowanie atomów w reakcjach chemicznych oraz na ich interakcje z innymi atomami.
W praktyce, aby obliczyć masę atomu, należy uwzględnić jedynie protony i neutrony, ponieważ elektrony mają znikomy wpływ na całkowitą masę. Masa atomowa jest najczęściej wyrażana w jednostkach masy atomowej (u), co oznacza, że 1 u to 1/12 masy izotopu węgla-12. Zrozumienie tego procesu jest nie tylko interesujące, ale również niezwykle przydatne w naukach przyrodniczych.
Zrozumienie struktury atomu i jego składników
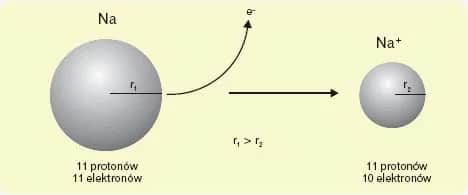
Aby obliczyć masę atomu, najpierw należy poznać jego strukturę. Atom składa się z jądra, które zawiera protony i neutrony, oraz chmury elektronów krążących wokół jądra. Protony mają ładunek dodatni, a neutrony są neutralne. Liczba protonów w jądrze określa, z jakim pierwiastkiem mamy do czynienia, natomiast liczba neutronów wpływa na masę atomu.
Warto również wspomnieć o izotopach, które są wariantami tego samego pierwiastka różniącymi się liczbą neutronów. Na przykład, węgiel występuje w dwóch głównych izotopach: węgiel-12 i węgiel-14. Oba mają sześć protonów, ale węgiel-12 ma sześć neutronów, a węgiel-14 ma osiem. Ta różnica w liczbie neutronów wpływa na masę atomową tych izotopów.
Rola protonów i neutronów w obliczaniu masy atomu
Protony i neutrony odgrywają kluczową rolę w obliczaniu masy atomu. To właśnie te cząstki znajdujące się w jądrze atomowym decydują o całkowitej masie atomowej. Każdy proton ma masę około 1 u, a neutron również ma masę zbliżoną do 1 u. Dlatego suma protonów i neutronów daje nam wartość masy atomowej, która jest istotna w chemii oraz fizyce.
Warto zauważyć, że liczba protonów w jądrze atomowym określa liczbę atomową, co z kolei definiuje, z jakim pierwiastkiem mamy do czynienia. Na przykład, atom węgla ma sześć protonów, co czyni go pierwiastkiem o liczbie atomowej 6. Neutrony natomiast mogą różnić się w zależności od izotopu, co wpływa na masę atomową danego pierwiastka, ale nie zmienia jego właściwości chemicznych.
Jak obliczyć masę atomu dla różnych pierwiastków
Obliczanie masy atomowej dla różnych pierwiastków jest prostym procesem. Najpierw należy zidentyfikować liczbę protonów i neutronów w jądrze atomowym danego pierwiastka. Można to zrobić, korzystając z tabeli okresowej, która dostarcza informacji o liczbie atomowej oraz liczbie masowej danego pierwiastka.
Przykładowo, aby obliczyć masę atomu węgla, należy uwzględnić jego 6 protonów i 6 neutronów, co daje łącznie 12. Na tej podstawie masa atomowa węgla wynosi 12 u. Dla izotopu węgla-14, który ma 6 protonów i 8 neutronów, masa atomowa wynosi 14 u. To pokazuje, jak różnice w liczbie neutronów wpływają na masę atomową.
Jednostki masy atomowej – co warto wiedzieć?
Jednostki masy atomowej, znane jako u (od angielskiego atomic mass unit), są kluczowe w obliczeniach związanych z masą atomową. Jedna jednostka masy atomowej jest definiowana jako 1/12 masy izotopu węgla-12. Dzięki temu możemy porównywać masy różnych atomów w sposób praktyczny i zrozumiały. Na przykład, masa atomowa tlenu wynosi około 16 u, co oznacza, że jest około 16 razy cięższa od 1/12 masy atomu węgla-12.
Warto zauważyć, że jednostki masy atomowej są używane w różnych kontekstach naukowych, od chemii po fizykę. Dlatego znajomość tych jednostek jest niezbędna dla każdego, kto chce zrozumieć, jak obliczać masę atomu i jak te obliczenia wpływają na różne procesy chemiczne. Użycie jednostek masy atomowej pozwala na precyzyjne określenie masy atomów oraz ich interakcji w reakcjach chemicznych.
Dlaczego masa atomowa jest istotna w chemii?
Masa atomowa odgrywa kluczową rolę w chemii, ponieważ wpływa na sposób, w jaki atomy łączą się i reagują ze sobą. W reakcjach chemicznych, masa atomowa jest używana do obliczania stosunków molowych, co pozwala chemikom przewidzieć, jak reagenty będą reagować. Na przykład, znajomość mas atomowych pozwala na ustalenie, ile gramów danego pierwiastka jest potrzebnych do reakcji z innym pierwiastkiem.
Co więcej, izotopy danego pierwiastka mogą mieć różne masy atomowe, co również wpływa na ich zachowanie w reakcjach chemicznych. Na przykład, izotop węgla-14 jest używany w datowaniu radiowęglowym, ponieważ jego masa atomowa oraz czas półtrwania są kluczowe dla określenia wieku organicznych materiałów. Dlatego zrozumienie masy atomowej jest nie tylko teoretyczne, ale ma praktyczne zastosowanie w różnych dziedzinach nauki.
Znaczenie jednostek masy atomowej w chemii i fizyce

Jednostki masy atomowej, oznaczane jako u, są kluczowe dla zrozumienia obliczeń związanych z masą atomową. Definicja 1/12 masy izotopu węgla-12 pozwala na precyzyjne porównanie mas różnych atomów, co jest niezbędne w chemii. Przykładowo, masa atomowa tlenu wynosi około 16 u, co wskazuje na jego stosunek masowy w kontekście innych pierwiastków. Użycie jednostek masy atomowej umożliwia naukowcom dokładne określenie mas atomów oraz ich interakcji w reakcjach chemicznych.
Oprócz tego, masa atomowa ma istotne znaczenie w praktycznych zastosowaniach, takich jak obliczanie stosunków molowych w reakcjach chemicznych. Zrozumienie, jak różne izotopy wpływają na masy atomowe, jest kluczowe dla przewidywania, jak reagenty będą reagować. Na przykład, izotop węgla-14, ze względu na swoją masę atomową i czas półtrwania, jest wykorzystywany w datowaniu radiowęglowym, co podkreśla praktyczne zastosowanie znajomości mas atomowych w naukach przyrodniczych.