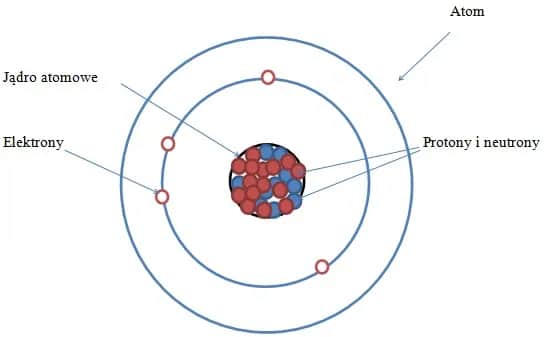
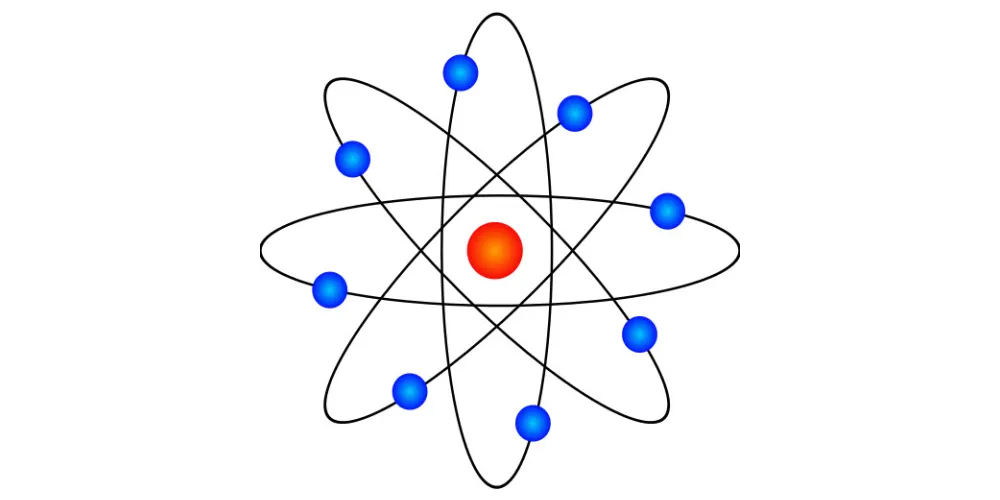
Atom to podstawowy element budulcowy materii, który tworzy wszystko, co nas otacza. Składa się z jądra, w którym znajdują się protony i neutrony, otoczonego chmurą elektronów. Jądro atomowe jest naładowane dodatnio dzięki obecności protonów, podczas gdy elektrony mają ładunek ujemny i krążą wokół jądra na określonych poziomach energetycznych. Atomy są niezwykle małe, a ich rozmiary zwykle mierzy się w pikometrach, co oznacza trilliontą część metra.
Struktura atomu pozwala mu na interakcję z innymi atomami poprzez tworzenie wiązań chemicznych, co prowadzi do powstawania cząsteczek i substancji. Zrozumienie, jak wygląda atom i jak funkcjonuje, jest kluczowe dla nauki o chemii oraz fizyce. W tym artykule przyjrzymy się bliżej budowie atomu, jego składnikom oraz znaczeniu w świecie materii. Kluczowe informacje:- Atom składa się z jądra i chmury elektronów.
- Jądro zawiera protony (ładunek dodatni) i neutrony (bez ładunku).
- Elektrony mają ładunek ujemny i krążą wokół jądra w określonych poziomach energetycznych.
- Rozmiar atomów jest mierzony w pikometrach.
- Atoms interact through chemical bonds, forming molecules and substances.
Jak wygląda atom? Wizualizacje i opisy jego struktury
Atom to fundamentalny element budulcowy materii. Zrozumienie jego struktury jest kluczowe dla nauk przyrodniczych. Wizualizacja atomu pomaga nam lepiej pojąć, jak funkcjonuje świat na poziomie mikroskopowym.
W centrum atomu znajduje się jądro, które składa się z protonów i neutronów. Otaczają je elektrony, które krążą wokół jądra na różnych poziomach energetycznych. Ta struktura atomu umożliwia interakcje z innymi atomami, co prowadzi do powstawania różnych substancji i cząsteczek.
Niezwykła budowa atomu: co składa się na jego strukturę?
Atom jest zbudowany z trzech głównych komponentów: protonów, neutronów i elektronów. Protony są naładowane dodatnio, a ich liczba w jądrze decyduje o tym, do jakiego pierwiastka należy atom. Neutrony nie mają ładunku i współdziałają z protonami, stabilizując jądro. Z kolei elektrony mają ładunek ujemny i poruszają się wokół jądra, tworząc chmurę elektronową.
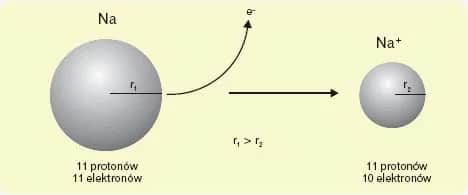
Warto zauważyć, że liczba protonów w jądrze atomowym jest równa liczbie elektronów w chmurze, co sprawia, że atom jest elektrycznie obojętny. Ta równowaga ładunków jest kluczowa dla stabilności atomu. W przypadku zmiany liczby elektronów, atom staje się jonem, co wpływa na jego właściwości chemiczne.Wnętrze atomu: rola jądra, protonów i neutronów
Jądro atomowe jest centralnym punktem atomu, w którym zachodzą najważniejsze procesy. Protony w jądrze są odpowiedzialne za właściwości chemiczne pierwiastka. Im więcej protonów, tym wyższa liczba atomowa, co określa miejsce pierwiastka w układzie okresowym.Neutrony pełnią kluczową rolę w stabilizacji jądra. Ich obecność pozwala na utrzymanie protonów w bliskim sąsiedztwie, co zapobiega ich odpychaniu się nawzajem (ze względu na ich dodatni ładunek). Bez neutronów, jądra atomowe byłyby niestabilne i szybko by się rozpadały. To właśnie dzięki tej unikalnej budowie atomy mogą tworzyć różnorodne substancje chemiczne.
Elektrony w atomie: ich rozmieszczenie i znaczenie
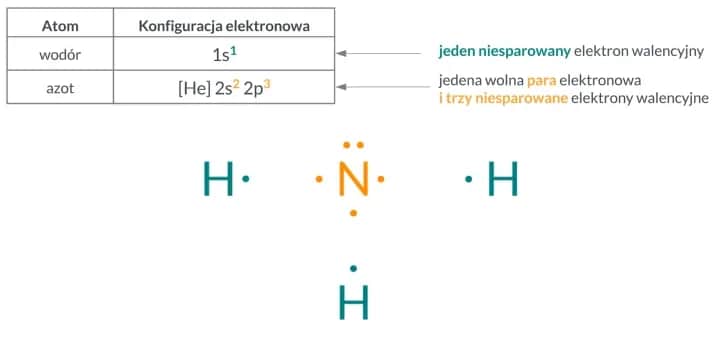
Elektrony odgrywają kluczową rolę w budowie atomu. Rozmieszczenie elektronów wokół jądra atomowego nie jest przypadkowe; określa je zasada zakazu Pauliego oraz zasady dotyczące poziomów energetycznych. Każdy poziom energetyczny może pomieścić określoną liczbę elektronów, co wpływa na reaktywność chemiczną atomów.
Na przykład, atomy z pełnymi powłokami elektronowymi są zazwyczaj stabilne i mniej skłonne do reakcji chemicznych. W przeciwieństwie do tego, atomy z niesparowanymi elektronami w swojej ostatniej powłoce są bardziej reaktywne, co prowadzi do powstawania różnych związków chemicznych. Zrozumienie, jak elektrony są rozmieszczone, jest kluczowe dla zrozumienia właściwości atomów w chemii.
Dlaczego atomy są tak małe? Zrozumienie skali atomowej
Atomy są niezwykle małe, a ich rozmiary są zwykle mierzone w pikometrach, co oznacza jedną bilionową część metra. Ta niewielka skala sprawia, że są one trudne do zaobserwowania gołym okiem. Zrozumienie skali atomowej jest istotne, ponieważ pozwala nam lepiej pojąć, jak atomy współdziałają ze sobą i tworzą różnorodne materiały.
Modele atomu: jak nauka przedstawia jego strukturę?
W historii nauki opracowano kilka modeli atomu, które próbują wyjaśnić jego strukturę. Najbardziej znane to model Rutherforda, który przedstawia atom jako małe jądro otoczone chmurą elektronów, oraz model Bohra, który wprowadza pojęcie wyraźnych orbit dla elektronów. Każdy z tych modeli przyczynił się do zrozumienia budowy atomu i jego właściwości, a także do rozwoju chemii jako nauki.
Wizualizacje atomu: przydatne diagramy i ilustracje
Wizualizacje atomu są niezbędne do zrozumienia jego struktury. Istnieje wiele typów diagramów, które pomagają przedstawić budowę atomu w sposób przystępny. Najpopularniejsze z nich to modele kulkowe, które pokazują atomy jako kulki połączone liniami reprezentującymi wiązania chemiczne.
Inne diagramy, takie jak modele orbitalne, ilustrują rozmieszczenie elektronów w chmurze wokół jądra. Te wizualizacje są kluczowe dla nauki o atomach w chemii, ponieważ pomagają zobrazować, jak atomy wchodzą w interakcje i tworzą różnorodne substancje.
Atom w chemii: jak jego budowa wpływa na właściwości materii?
Budowa atomu ma ogromny wpływ na jego właściwości chemiczne. Na przykład, liczba protonów w jądrze decyduje o tym, do jakiego pierwiastka należy atom, a zatem wpływa na jego zachowanie w reakcjach chemicznych. Struktura atomu kształtuje również sposób, w jaki atomy łączą się w cząsteczki, co jest kluczowe dla zrozumienia procesów chemicznych.
Dodatkowo, rozmieszczenie elektronów w atomie wpływa na jego reaktywność. Atomy z pełnymi powłokami elektronowymi są zazwyczaj stabilne i mniej skłonne do reakcji, podczas gdy atomy z niesparowanymi elektronami są bardziej reaktywne. To wszystko sprawia, że modele atomu i ich zrozumienie są fundamentem chemii.| Właściwość | Opis |
| Liczba protonów | Określa pierwiastek i jego położenie w układzie okresowym |
| Rozmieszczenie elektronów | Wpływa na reaktywność i zdolność do tworzenia wiązań chemicznych |
| Stabilność jądra | Decyduje o trwałości atomu i jego interakcji z innymi atomami |
Budowa atomu decyduje o jego właściwościach chemicznych
W artykule omówiono, jak budowa atomu wpływa na jego właściwości chemiczne, co jest kluczowe dla zrozumienia interakcji między atomami. Liczba protonów w jądrze decyduje o tym, do jakiego pierwiastka należy atom, a tym samym kształtuje jego zachowanie w reakcjach chemicznych. Na przykład, atomy z pełnymi powłokami elektronowymi są stabilne i mniej skłonne do reakcji, podczas gdy atomy z niesparowanymi elektronami wykazują większą reaktywność, co podkreśla znaczenie rozmieszczenia elektronów w chmurze elektronowej.
Dodatkowo, artykuł zwraca uwagę na to, jak modele atomu pomagają zrozumieć te właściwości. Dzięki wizualizacjom, takim jak modele kulkowe czy orbitalne, można lepiej pojąć, jak atomy łączą się w cząsteczki i jak ich struktura wpływa na różnorodność substancji chemicznych. To wszystko podkreśla, że zrozumienie struktury atomu jest kluczowe dla nauk przyrodniczych i chemii w szczególności.