Atom to podstawowy budulec materii, ale jego wygląd nie jest tak prosty, jak mogłoby się wydawać. Choć często przedstawia się go jako małą kulkę z krążącymi wokół niej elektronami, rzeczywistość jest znacznie bardziej złożona. Atom składa się z jądra, w którym skupiona jest większość jego masy, oraz elektronów poruszających się wokół niego w określonych obszarach zwanych powłokami elektronowymi.
Wizualizacja atomu to jedno z największych wyzwań nauki, ponieważ jego rozmiar jest niewyobrażalnie mały, a zachowanie elektronów nie przypomina ruchu planet wokół Słońca. W tym artykule przyjrzymy się, jak naprawdę wygląda atom, jakie modele pomagają go zrozumieć i dlaczego nie można go zobaczyć gołym okiem.
Kluczowe informacje:- Atom składa się z jądra (protony i neutrony) oraz elektronów krążących wokół niego.
- Większość masy atomu skupiona jest w jądrze, które jest niezwykle małe w porównaniu do całego atomu.
- Elektrony nie poruszają się po stałych orbitach, lecz tworzą chmurę elektronową o różnym prawdopodobieństwie występowania.
- Rozmiar atomu określa się na podstawie odległości między jądrami sąsiednich atomów w wiązaniach chemicznych.
- Współczesne modele atomu, takie jak model chmury elektronowej, lepiej oddają jego złożoną naturę niż klasyczny model Bohra.
Czym jest atom i jak go sobie wyobrazić?
Atom to najmniejsza jednostka materii, która zachowuje właściwości chemiczne pierwiastka. Choć często przedstawiany jest jako mała kulka z krążącymi wokół niej elektronami, jak wygląda atom w rzeczywistości, jest znacznie bardziej skomplikowane. Jego struktura nie przypomina niczego, co możemy zobaczyć gołym okiem.
Atom nie ma klasycznego kształtu, ponieważ składa się z subatomowych cząstek, które zachowują się zgodnie z zasadami mechaniki kwantowej. Elektrony nie krążą po stałych orbitach, lecz tworzą chmurę, w której ich położenie jest określane przez prawdopodobieństwo. To właśnie dlatego atom nie wygląda jak kulka, a jego wizualizacja wymaga specjalnych modeli.
Budowa atomu: co składa się na jego strukturę?
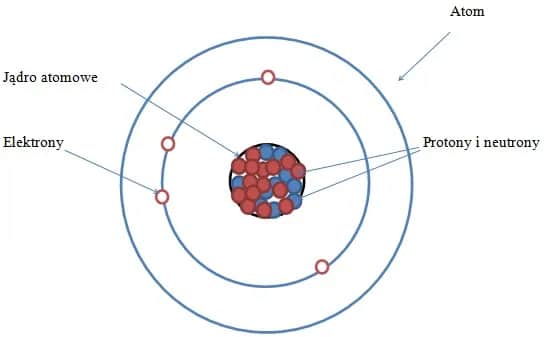
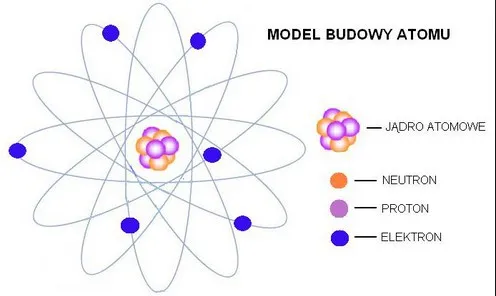
Atom składa się z dwóch głównych części: jądra atomowego i elektronów. Jądro, choć niewielkie, skupia prawie całą masę atomu. To właśnie tam znajdują się protony i neutrony, które nadają atomowi jego unikalne właściwości.
Protony to cząstki o dodatnim ładunku elektrycznym, które decydują o liczbie atomowej pierwiastka. Neutrony, z kolei, są elektrycznie obojętne, ale odgrywają kluczową rolę w stabilności jądra. Razem tworzą one centrum atomu, wokół którego krążą elektrony.
Elektrony to ujemnie naładowane cząstki, które poruszają się wokół jądra w obszarach zwanych powłokami elektronowymi. Ich ruch nie przypomina jednak orbit planetarnych, lecz jest bardziej chaotyczny i opisywany przez mechanikę kwantową. To właśnie elektrony odpowiadają za tworzenie wiązań chemicznych między atomami.
Jądro atomowe: centrum masy i ładunku
Jądro atomowe to serce atomu, w którym skupiona jest większość jego masy. Mimo że zajmuje zaledwie ułamek przestrzeni atomu, to właśnie tam znajdują się protony i neutrony. Protony nadają jądru dodatni ładunek, podczas gdy neutrony stabilizują jego strukturę.
Rozmiar jądra jest niezwykle mały w porównaniu do całego atomu. Gdyby atom był wielkości stadionu piłkarskiego, jądro miałoby rozmiar ziarnka piasku. Mimo to, jego gęstość jest ogromna, co sprawia, że większość masy atomu skupiona jest w tym niewielkim obszarze.
- Protony: dodatnio naładowane cząstki, decydujące o liczbie atomowej pierwiastka.
- Neutrony: elektrycznie obojętne cząstki, stabilizujące jądro atomowe.
- Elektrony: ujemnie naładowane cząstki, tworzące chmurę wokół jądra.
Elektrony: jak poruszają się wokół jądra?
Elektrony nie poruszają się po stałych orbitach, jak to przedstawiano w klasycznych modelach atomu. Zamiast tego, ich położenie jest opisywane przez chmurę elektronową, która pokazuje prawdopodobieństwo znalezienia elektronu w danym miejscu.
Chmura elektronowa to obszar, w którym elektrony mogą się poruszać, ale nie ma tam wyraźnych ścieżek. To właśnie dlatego atom nie wygląda jak kulka, a jego kształt jest bardziej rozmyty i trudny do zdefiniowania. Współczesne modele atomu opierają się na tej koncepcji, aby lepiej opisać jego zachowanie.
| Cząstka | Ładunek | Masa |
| Proton | +1 | 1,67 × 10⁻²⁷ kg |
| Neutron | 0 | 1,67 × 10⁻²⁷ kg |
| Elektron | -1 | 9,11 × 10⁻³¹ kg |
Czytaj więcej: Jak określić atom centralny w związkach chemicznych łatwo i szybko
Modele atomowe: od Bohra do chmury elektronowej
Zrozumienie, jak wygląda atom, wymagało lat badań i rozwoju różnych modeli. Pierwsze modele, takie jak model Bohra, były prostymi próbami wyjaśnienia struktury atomu. Dziś wiemy, że atom jest znacznie bardziej złożony, a współczesne modele opierają się na mechanice kwantowej.
Model Bohra, choć przestarzały, był ważnym krokiem w zrozumieniu atomu. Przedstawiał on elektrony krążące po stałych orbitach wokół jądra, co pomogło wyjaśnić niektóre zjawiska fizyczne. Jednak z czasem okazało się, że ten model nie jest wystarczająco dokładny, aby opisać zachowanie elektronów.
Współczesne modele atomu, takie jak model chmury elektronowej, opierają się na zasadach mechaniki kwantowej. W tym ujęciu elektrony nie poruszają się po stałych orbitach, lecz tworzą chmurę, w której ich położenie jest określane przez prawdopodobieństwo. To właśnie ten model najlepiej oddaje, jak naprawdę wygląda atom.
Model Bohra: prosty sposób na zrozumienie atomu
Model Bohra, zaproponowany w 1913 roku, był pierwszym modelem, który próbował wyjaśnić strukturę atomu. Zgodnie z tym modelem, elektrony krążą po stałych orbitach wokół jądra, podobnie jak planety wokół Słońca. Każda orbita miała określoną energię, a elektrony mogły przeskakiwać między nimi, emitując lub pochłaniając energię.
Choć model Bohra był przełomowy, miał swoje ograniczenia. Nie wyjaśniał on zachowania elektronów w bardziej złożonych atomach ani nie uwzględniał efektów kwantowych. Mimo to, był ważnym krokiem w zrozumieniu, jak wygląda atom, i do dziś jest używany jako wprowadzenie do tematu.
Model chmury elektronowej: jak wygląda atom dziś?
Współczesny model atomu, znany jako model chmury elektronowej, opiera się na mechanice kwantowej. W tym ujęciu elektrony nie poruszają się po stałych orbitach, lecz tworzą chmurę, w której ich położenie jest określane przez prawdopodobieństwo. To właśnie ta chmura elektronowa decyduje o kształcie atomu.
Chmura elektronowa nie ma wyraźnych granic, co sprawia, że atom nie wygląda jak kulka. Zamiast tego, elektrony mogą znajdować się w różnych obszarach wokół jądra, tworząc rozmyty kształt. To właśnie dlatego atom nie ma klasycznego kształtu, a jego wizualizacja wymaga specjalnych technik.
Wizualizacje atomu: jak nauka pokazuje jego strukturę?
 Wizualizacja atomu to jedno z największych wyzwań nauki. Dzięki nowoczesnym technikom, takim jak mikroskopia elektronowa, możemy zobaczyć struktury atomowe z niespotykaną dotąd dokładnością. Te metody pozwalają naukowcom lepiej zrozumieć, jak wygląda atom i jak zachowują się jego składniki.
Wizualizacja atomu to jedno z największych wyzwań nauki. Dzięki nowoczesnym technikom, takim jak mikroskopia elektronowa, możemy zobaczyć struktury atomowe z niespotykaną dotąd dokładnością. Te metody pozwalają naukowcom lepiej zrozumieć, jak wygląda atom i jak zachowują się jego składniki.
Wizualizacje atomu są nie tylko ważne dla nauki, ale także dla edukacji. Dzięki nim możemy lepiej zrozumieć złożoność świata mikroskopijnych cząstek. To właśnie te techniki pozwalają nam zobaczyć, że atom nie jest prostą kulką, lecz skomplikowaną strukturą, której kształt jest trudny do zdefiniowania.
- Mikroskopia elektronowa: pozwala zobaczyć struktury atomowe z wysoką rozdzielczością.
- Spektroskopia: analizuje światło emitowane przez atomy, aby określić ich właściwości.
- Tomografia atomowa: tworzy trójwymiarowe obrazy atomów w materiałach.
Atom to nie kulka: współczesne spojrzenie na jego strukturę
W artykule przyjrzeliśmy się, dlaczego atom nie wygląda jak klasyczna kulka, a jego struktura jest znacznie bardziej złożona. Dzięki modelom, takim jak chmura elektronowa, zrozumieliśmy, że elektrony nie poruszają się po stałych orbitach, lecz tworzą obszary o różnym prawdopodobieństwie występowania. To właśnie ta chmura elektronowa sprawia, że atom nie ma wyraźnego kształtu.
Przeanalizowaliśmy również, jak modele atomowe ewoluowały od prostego modelu Bohra do współczesnych teorii kwantowych. Model Bohra, choć przydatny w edukacji, nie był w stanie wyjaśnić złożoności zachowania elektronów. Dziś wiemy, że atom to dynamiczna struktura, której wizualizacja wymaga zaawansowanych technik, takich jak mikroskopia elektronowa czy spektroskopia.
Podsumowując, atom nie jest statycznym obiektem, lecz skomplikowanym układem cząstek, których zachowanie opisuje mechanika kwantowa. To właśnie dlatego jego wizualizacja jest tak trudna, a współczesne modele pozwalają nam lepiej zrozumieć jego prawdziwą naturę.