Izotopy to odmiany tego samego pierwiastka chemicznego, które różnią się liczbą neutronów w jądrze atomowym. Mają one taką samą liczbę protonów, co oznacza, że należą do tego samego pierwiastka, ale ich masa atomowa jest inna. Izotopy odgrywają kluczową rolę w chemii, fizyce, medycynie, a nawet w życiu codziennym. Warto poznać ich definicję, przykłady oraz praktyczne zastosowania, aby zrozumieć, dlaczego są tak ważne.
W przyrodzie występują zarówno izotopy stabilne, które nie ulegają rozpadowi, jak i izotopy niestabilne (promieniotwórcze), które emitują promieniowanie. To właśnie te właściwości sprawiają, że izotopy są wykorzystywane w różnych dziedzinach nauki i technologii. W tym artykule dowiesz się, czym dokładnie są izotopy, jakie są ich rodzaje oraz jak wpływają na nasze życie.
Najważniejsze informacje:- Izotopy to odmiany pierwiastków o tej samej liczbie protonów, ale różnej liczbie neutronów.
- Wyróżniamy izotopy stabilne (niepromieniotwórcze) i niestabilne (promieniotwórcze).
- Izotopy mają szerokie zastosowanie w medycynie, energetyce, przemyśle i badaniach naukowych.
- Przykłady izotopów to węgiel-14 (używany w datowaniu) i jod-131 (stosowany w leczeniu chorób tarczycy).
- Izotopy promieniotwórcze mogą być niebezpieczne, ale ich odpowiednie wykorzystanie przynosi wiele korzyści.
Co to są izotopy? Prosta definicja i podstawowe informacje
Izotopy to odmiany tego samego pierwiastka chemicznego, które różnią się liczbą neutronów w jądrze atomowym. Mają one taką samą liczbę protonów, co oznacza, że należą do tego samego pierwiastka, ale ich masa atomowa jest inna. Izotopy definicja obejmuje zarówno stabilne, jak i niestabilne formy, które mogą występować naturalnie lub być wytwarzane sztucznie. Poniższa tabela przedstawia przykłady izotopów wraz z ich właściwościami.
| Nazwa izotopu | Liczba protonów | Liczba neutronów | Masa atomowa (u) | Typ izotopu |
|---|---|---|---|---|
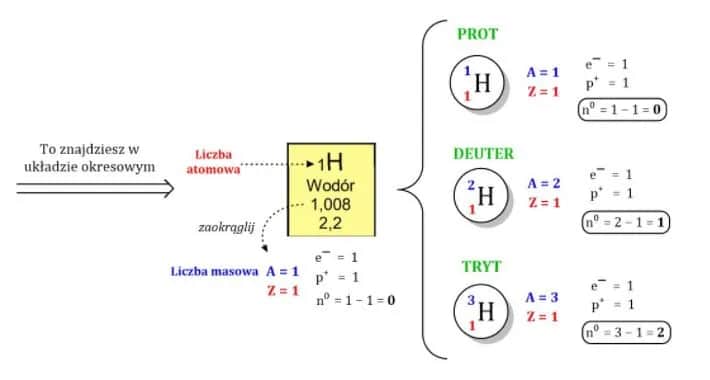
| Wodór-1 | 1 | 0 | 1,0078 u | Stabilny |
| Wodór-2 (Deuter) | 1 | 1 | 2,0141 u | Stabilny |
| Węgiel-12 | 6 | 6 | 12,0000 u | Stabilny |
| Węgiel-14 | 6 | 8 | 14,0032 u | Niestabilny |
| Uran-235 | 92 | 143 | 235,0439 u | Niestabilny |
Jak powstają izotopy i dlaczego są ważne w chemii?
Izotopy powstają w wyniku naturalnych procesów, takich jak reakcje jądrowe w gwiazdach, lub są wytwarzane sztucznie w laboratoriach. Proces ten polega na zmianie liczby neutronów w jądrze atomowym, co prowadzi do powstania różnych odmian tego samego pierwiastka. Izotopy stabilne i niestabilne odgrywają kluczową rolę w badaniach naukowych, ponieważ pozwalają na śledzenie procesów chemicznych i biologicznych.
W chemii izotopy są wykorzystywane do badania struktury związków oraz mechanizmów reakcji. Na przykład, izotop węgla-14 jest używany w datowaniu radiometrycznym, co pozwala określić wiek skamieniałości. Zastosowanie izotopów w chemii obejmuje również medycynę, gdzie służą one do diagnozowania i leczenia chorób.
Różnice między izotopami a innymi formami pierwiastków
Izotopy różnią się od innych form pierwiastków, takich jak izobary i izotony, przede wszystkim liczbą neutronów. Różnica między izotopami a izobarami polega na tym, że izobary mają tę samą masę atomową, ale różną liczbę protonów. Izotony natomiast mają taką samą liczbę neutronów, ale różną liczbę protonów. Poniższa lista porównuje te trzy pojęcia:
- Izotopy: Ta sama liczba protonów, różna liczba neutronów.
- Izobary: Ta sama masa atomowa, różna liczba protonów.
- Izotony: Ta sama liczba neutronów, różna liczba protonów.
Izotopy stabilne i niestabilne – czym się różnią?
Izotopy stabilne to takie, które nie ulegają rozpadowi i pozostają niezmienione przez długi czas. Przykładem jest węgiel-12, który jest powszechnie występujący w przyrodzie. Izotopy stabilne są wykorzystywane w badaniach naukowych, ponieważ nie emitują promieniowania i są bezpieczne w użyciu.
Z kolei izotopy niestabilne, zwane również promieniotwórczymi, ulegają rozpadowi, emitując promieniowanie. Przykładem jest węgiel-14, który jest używany w datowaniu radiometrycznym. Chociaż izotopy promieniotwórcze mogą być niebezpieczne, ich odpowiednie wykorzystanie przynosi wiele korzyści, np. w medycynie nuklearnej.
Czytaj więcej: Co można studiować po biol-chem? Najlepsze kierunki i perspektywy zawodowe
Praktyczne zastosowania izotopów w życiu codziennym
Izotopy mają szerokie zastosowanie w różnych dziedzinach życia. W medycynie są używane do diagnozowania i leczenia chorób, np. jod-131 w leczeniu tarczycy. W energetyce izotopy uranu-235 są wykorzystywane do produkcji energii w elektrowniach jądrowych. Zastosowanie izotopów w chemii obejmuje również przemysł, gdzie służą one do kontroli jakości i badania materiałów.
| Izotop | Zastosowanie | Dziedzina | Korzyści |
|---|---|---|---|
| Węgiel-14 | Datowanie radiometryczne | Archeologia | Określanie wieku skamieniałości |
| Jod-131 | Leczenie tarczycy | Medycyna | Terapia nowotworów |
| Uran-235 | Produkcja energii | Energetyka | Niskie emisje CO2 |
| Kobalt-60 | Sterylizacja sprzętu | Przemysł | Bezpieczeństwo medyczne |
| Trit (Wodór-3) | Badania naukowe | Chemia | Śledzenie reakcji |
Pamiętaj, że izotopy promieniotwórcze wymagają specjalnego traktowania. Zawsze korzystaj z nich pod nadzorem specjalistów, aby uniknąć zagrożeń dla zdrowia.
Jak izotopy pomagają w badaniach naukowych i technologii?
Izotopy są nieocenione w badaniach naukowych, szczególnie w dziedzinie datowania radiometrycznego. Węgiel-14, jeden z najbardziej znanych izotopów, pozwala określić wiek skamieniałości i artefaktów archeologicznych z dokładnością do kilku tysięcy lat. To właśnie dzięki niemu możemy lepiej zrozumieć historię Ziemi i ewolucję życia.
W technologii izotopy znajdują zastosowanie w diagnostyce medycznej. Na przykład, technet-99m jest używany w obrazowaniu narządów wewnętrznych, co pozwala na wczesne wykrywanie chorób. Zastosowanie izotopów w chemii i medycynie to tylko wierzchołek góry lodowej – ich potencjał jest ogromny i wciąż odkrywany.
Czy izotopy mogą być niebezpieczne? Fakty i mity
Izotopy promieniotwórcze mogą stanowić zagrożenie, jeśli nie są odpowiednio kontrolowane. Emitują one promieniowanie, które w dużych dawkach może uszkodzić tkanki i prowadzić do chorób. Jednak przy odpowiednim zabezpieczeniu i nadzorze, ich zastosowanie jest bezpieczne i przynosi wiele korzyści.
Pamiętaj, że izotopy promieniotwórcze wymagają specjalnego traktowania. Zawsze korzystaj z nich pod nadzorem specjalistów, aby uniknąć zagrożeń dla zdrowia.
Najważniejsze izotopy w przyrodzie i ich właściwości
W przyrodzie występuje wiele izotopów, ale niektóre z nich są szczególnie istotne. Wodór-1, najlżejszy izotop wodoru, stanowi ponad 99% tego pierwiastka na Ziemi. Jego cięższa odmiana, wodór-2 (deuter), jest używana w badaniach naukowych i energetyce jądrowej.
Innym ważnym izotopem jest węgiel-12, który stanowi podstawę życia organicznego. Jego niestabilny odpowiednik, węgiel-14, jest kluczowy w datowaniu radiometrycznym. Te izotopy pokazują, jak różnorodne mogą być zastosowania nawet jednego pierwiastka.
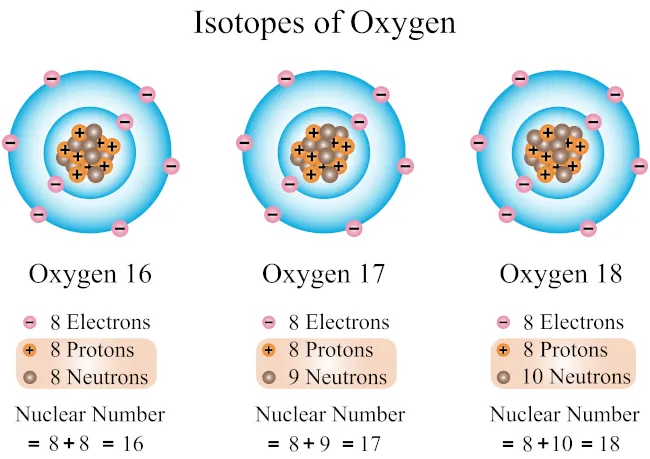
Jak izotopy wpływają na środowisko naturalne?
Izotopy mają zarówno pozytywny, jak i negatywny wpływ na środowisko. Z jednej strony, są wykorzystywane do monitorowania zanieczyszczeń i badania ekosystemów. Z drugiej strony, izotopy promieniotwórcze mogą powodować skażenie, jeśli nie są odpowiednio zarządzane. Poniższa lista przedstawia kluczowe przykłady wpływu izotopów na środowisko:
- Węgiel-14: Używany do badania zmian klimatycznych i cykli węglowych w przyrodzie.
- Jod-131: Może powodować skażenie gleby i wody po awariach jądrowych.
- Uran-235: Jego wydobycie i wykorzystanie w energetyce może prowadzić do degradacji środowiska.
- Trit (Wodór-3): Stosowany w badaniach oceanograficznych do śledzenia prądów morskich.
Przyszłość izotopów – nowe odkrycia i perspektywy
Izotopy wciąż zaskakują naukowców swoim potencjałem. Nowe technologie, takie jak terapia protonowa, wykorzystują izotopy do precyzyjnego leczenia nowotworów. To tylko jeden z wielu przykładów, jak izotopy mogą zmieniać medycynę i poprawiać jakość życia.
W przyszłości izotopy mogą znaleźć zastosowanie w jeszcze bardziej zaawansowanych dziedzinach, takich jak energetyka fuzyjna czy nanotechnologia. Zastosowanie izotopów w chemii i innych naukach wciąż się rozwija, a ich rola w postępie technologicznym jest nie do przecenienia.
Izotopy – klucz do przyszłości nauki i technologii
Izotopy odgrywają kluczową rolę w rozwoju nauki i technologii, oferując rozwiązania w medycynie, energetyce i badaniach środowiskowych. Przykładem jest węgiel-14, który umożliwia datowanie radiometryczne, oraz technet-99m, stosowany w diagnostyce medycznej. Te izotopy pokazują, jak różnorodne mogą być ich zastosowania w praktyce.
Jednak izotopy promieniotwórcze wymagają szczególnej ostrożności, ponieważ mogą stanowić zagrożenie dla zdrowia i środowiska. Przykładem jest jod-131, który po awariach jądrowych może skazić glebę i wodę. Mimo to, przy odpowiednim zarządzaniu, ich korzyści przewyższają potencjalne ryzyka.
Przyszłość izotopów jest obiecująca, zwłaszcza w dziedzinach takich jak terapia protonowa czy energetyka fuzyjna. Ich zastosowanie w chemii i innych naukach wciąż się rozwija, co czyni je nieodzownym narzędziem w dalszym postępie technologicznym.