Elektrolity to substancje, które odgrywają kluczową rolę w chemii, zarówno w teorii, jak i w praktyce. Co to dokładnie jest elektrolit? To związek chemiczny, który po rozpuszczeniu w wodzie lub stopieniu ulega dysocjacji na jony, dzięki czemu może przewodzić prąd elektryczny. Elektrolity są niezbędne w wielu procesach chemicznych, biologicznych i technologicznych, a ich zrozumienie jest podstawą do nauki o reakcjach chemicznych.
W tym artykule wyjaśnimy, jak działają elektrolity, podamy przykłady ich występowania oraz omówimy ich praktyczne zastosowania w życiu codziennym i przemyśle. Dowiesz się również, dlaczego są one tak ważne dla organizmu człowieka oraz jak wpływają na funkcjonowanie baterii i akumulatorów. To kompleksowe wprowadzenie do tematu, które pomoże Ci zrozumieć, czym są elektrolity i jaką rolę pełnią w chemii. Najważniejsze informacje:- Elektrolity to substancje, które po rozpuszczeniu lub stopieniu przewodzą prąd elektryczny dzięki obecności jonów.
- Dzielą się na mocne i słabe, w zależności od stopnia dysocjacji w roztworze.
- Przykłady elektrolitów to m.in. sól kuchenna, kwasy i zasady.
- Elektrolity są niezbędne w reakcjach chemicznych, procesach biologicznych oraz w technologii, np. w bateriach.
- Ich niedobór w organizmie może prowadzić do poważnych zaburzeń zdrowotnych.
Co to jest elektrolit i jak działa w chemii?
Elektrolity to substancje, które odgrywają kluczową rolę w chemii. Po rozpuszczeniu w wodzie lub stopieniu ulegają dysocjacji na jony, co umożliwia przewodzenie prądu elektrycznego. To właśnie dzięki temu zjawisku elektrolity w chemii są niezbędne w wielu procesach, od reakcji chemicznych po funkcjonowanie organizmów żywych.
| Nazwa elektrolitu | Stopień dysocjacji (%) | Przewodnictwo (S/cm) | Typowe zastosowanie |
|---|---|---|---|
| Chlorek sodu (NaCl) | 90% | 0.05 S/cm | Przemysł spożywczy, medycyna |
| Kwas solny (HCl) | 95% | 0.08 S/cm | Produkcja chemikaliów |
| Wodorotlenek sodu (NaOH) | 85% | 0.06 S/cm | Przemysł papierniczy |
| Kwas octowy (CH₃COOH) | 5% | 0.01 S/cm | Przemysł spożywczy |
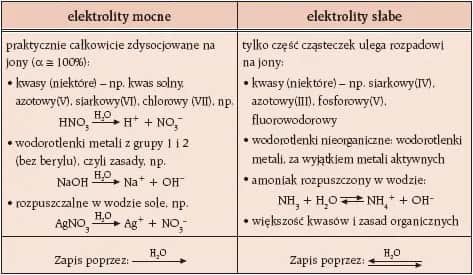
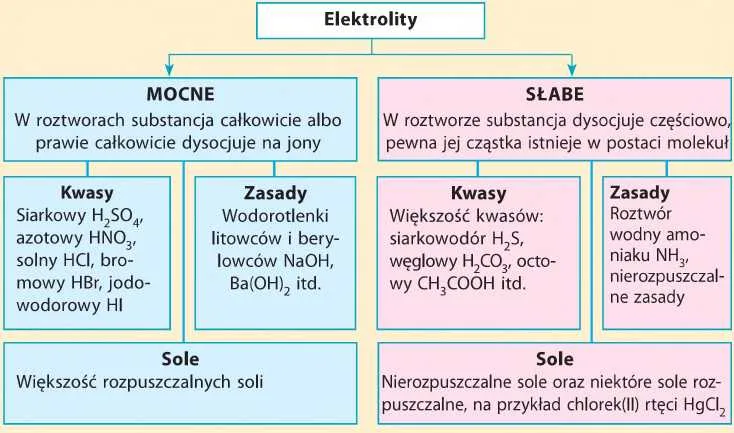
Rodzaje elektrolitów: mocne i słabe
Mocne elektrolity to substancje, które niemal całkowicie ulegają dysocjacji w roztworze. Przykłady to sól kuchenna (NaCl) czy kwas solny (HCl). Dzięki wysokiemu stopniowi dysocjacji są one doskonałymi przewodnikami prądu elektrycznego.
Słabe elektrolity dysocjują tylko częściowo, co oznacza, że w roztworze pozostaje sporo nierozłożonych cząsteczek. Przykładem jest kwas octowy (CH₃COOH), który w roztworze wodnym dysocjuje w zaledwie 5%. Mimo to, ich rola elektrolitów w chemii jest równie istotna, zwłaszcza w procesach biologicznych.
Przykłady elektrolitów w codziennym życiu
Elektrolity otaczają nas na co dzień, choć często nie zdajemy sobie z tego sprawy. Sól kuchenna, używana w kuchni, to jeden z najprostszych przykładów. Kwas cytrynowy, obecny w owocach, również działa jako elektrolit. Nawet napoje izotoniczne zawierają mieszankę elektrolitów, które pomagają uzupełnić straty minerałów podczas wysiłku fizycznego.
- Sól kuchenna (NaCl) – stosowana w kuchni i przemyśle spożywczym.
- Kwas cytrynowy – obecny w owocach i napojach.
- Wodorotlenek sodu (NaOH) – używany w produkcji mydła i detergentów.
- Kwas solny (HCl) – stosowany w przemyśle chemicznym.
Jak elektrolity wpływają na reakcje chemiczne?
Elektrolity odgrywają kluczową rolę w reakcjach chemicznych, zwłaszcza tych zachodzących w roztworach wodnych. Dzięki obecności jonów przyspieszają one procesy chemiczne, takie jak hydroliza czy reakcje redoks. To właśnie dlatego są niezbędne w wielu procesach przemysłowych.
W procesach elektrochemicznych, takich jak praca baterii, elektrolity pełnią funkcję medium przewodzącego. Umożliwiają one przepływ jonów między elektrodami, co jest podstawą działania ogniw galwanicznych. Bez nich nie byłoby możliwe magazynowanie energii w bateriach.
Czytaj więcej: Chemia przy nowotworze: jak działa chemioterapia i czy warto się jej bać?
Zastosowanie elektrolitów w przemyśle i medycynie
Elektrolity mają szerokie zastosowanie w przemyśle, od produkcji chemikaliów po wytwarzanie energii. W medycynie są niezbędne do utrzymania równowagi elektrolitowej w organizmie. Stosuje się je również w terapii odwodnienia oraz w leczeniu zaburzeń metabolicznych.
W przemyśle spożywczym elektrolity są używane do konserwacji żywności, a w kosmetyce – do produkcji kremów i balsamów. Ich uniwersalność sprawia, że są niezastąpione w wielu dziedzinach życia.Pamiętaj, że praca z elektrolitami wymaga zachowania ostrożności. Zawsze noś rękawice ochronne i okulary, aby uniknąć kontaktu z substancjami żrącymi.
Dlaczego elektrolity są ważne dla organizmu człowieka?
Elektrolity są niezbędne do prawidłowego funkcjonowania organizmu. Regulują one pracę mięśni, nerwów oraz utrzymują równowagę wodno-elektrolitową. Bez nich niemożliwe byłoby przesyłanie impulsów nerwowych czy kurczenie się mięśni.
Niedobór elektrolitów może prowadzić do poważnych konsekwencji. Skurcze mięśni, osłabienie, a nawet zaburzenia rytmu serca to tylko niektóre z objawów. Dlatego tak ważne jest regularne uzupełnianie elektrolitów, zwłaszcza podczas intensywnego wysiłku fizycznego.
Jak rozpoznać elektrolity w substancjach?
 Istnieją proste testy, które pozwalają zidentyfikować elektrolity. Jednym z nich jest pomiar przewodnictwa elektrycznego roztworu. Jeśli substancja przewodzi prąd, istnieje duże prawdopodobieństwo, że jest elektrolitem.
Istnieją proste testy, które pozwalają zidentyfikować elektrolity. Jednym z nich jest pomiar przewodnictwa elektrycznego roztworu. Jeśli substancja przewodzi prąd, istnieje duże prawdopodobieństwo, że jest elektrolitem.
| Test | Wynik dodatni | Wynik ujemny | Przykład substancji |
|---|---|---|---|
| Pomiar przewodnictwa | Prąd płynie | Prąd nie płynie | Chlorek sodu (NaCl) |
| Test pH | pH < 7 lub > 7 | pH = 7 | Kwas solny (HCl) |
| Reakcja z wskaźnikami | Zmiana koloru | Brak zmiany | Wodorotlenek sodu (NaOH) |
| Test rozpuszczalności | Rozpuszcza się w wodzie | Nie rozpuszcza się | Kwas octowy (CH₃COOH) |
Czy wszystkie substancje przewodzące to elektrolity?
Nie wszystkie substancje przewodzące prąd to elektrolity. Metale, takie jak miedź czy aluminium, również przewodzą prąd, ale nie są elektrolitami. Różnica polega na mechanizmie przewodzenia – metale przewodzą elektrony, a elektrolity jony.
Warto pamiętać, że tylko substancje, które ulegają dysocjacji na jony w roztworze, są klasyfikowane jako elektrolity. To właśnie ta cecha odróżnia je od innych przewodników.
Elektrolity w bateriach i akumulatorach
Elektrolity są kluczowym elementem baterii i akumulatorów. W ogniwach galwanicznych pełnią funkcję medium, które umożliwia przepływ jonów między elektrodami. Dzięki temu możliwe jest magazynowanie i uwalnianie energii.
- Baterie litowo-jonowe – stosowane w telefonach i laptopach.
- Akumulatory kwasowo-ołowiowe – używane w samochodach.
- Ogniwa paliwowe – wykorzystywane w energetyce.
- Baterie alkaliczne – popularne w urządzeniach przenośnych.
Jakie są najczęstsze błędy w rozumieniu elektrolitów?
Jednym z najczęstszych błędów jest mylenie elektrolitów z innymi substancjami przewodzącymi. Nie każda substancja, która przewodzi prąd, jest elektrolitem. To właśnie jony, a nie elektrony, decydują o ich właściwościach.
Innym błędem jest przekonanie, że wszystkie elektrolity są silnie żrące. W rzeczywistości wiele z nich, takich jak sól kuchenna, jest całkowicie bezpiecznych w codziennym użyciu. Kluczem jest zrozumienie ich właściwości i zastosowań.
Praktyczne porady: Jak bezpiecznie pracować z elektrolitami?
Praca z elektrolitami wymaga zachowania ostrożności. Zawsze noś rękawice ochronne i okulary, aby uniknąć kontaktu z substancjami żrącymi. Przechowuj je w odpowiednio oznakowanych pojemnikach, z dala od dzieci i zwierząt.
Jeśli pracujesz z silnymi elektrolitami, takimi jak kwas solny, zawsze rób to w dobrze wentylowanym pomieszczeniu. Unikaj wdychania oparów, które mogą być szkodliwe dla zdrowia.
Elektrolity: klucz do zrozumienia chemii i technologii
Elektrolity to substancje, które odgrywają kluczową rolę zarówno w chemii, jak i w codziennym życiu. Jak pokazano w artykule, ich zdolność do dysocjacji na jony umożliwia przewodzenie prądu elektrycznego, co jest niezbędne w reakcjach chemicznych, procesach biologicznych oraz w technologii, np. w bateriach litowo-jonowych. Przykłady takie jak sól kuchenna czy kwas solny ilustrują, jak powszechne są elektrolity w naszym otoczeniu.
Artykuł podkreśla również, że elektrolity mają kluczowe znaczenie dla organizmu człowieka, regulując pracę mięśni i nerwów. Ich niedobór może prowadzić do poważnych konsekwencji zdrowotnych, takich jak skurcze mięśni czy zaburzenia rytmu serca. W przemyśle i medycynie znajdują szerokie zastosowanie, od produkcji chemikaliów po leczenie odwodnienia.
Warto pamiętać, że nie wszystkie substancje przewodzące to elektrolity. Metale, takie jak miedź, przewodzą prąd dzięki elektronom, a nie jonom. To właśnie dysocjacja na jony odróżnia elektrolity od innych przewodników. Bezpieczna praca z elektrolitami wymaga zachowania ostrożności, zwłaszcza przy substancjach żrących, takich jak kwas solny.