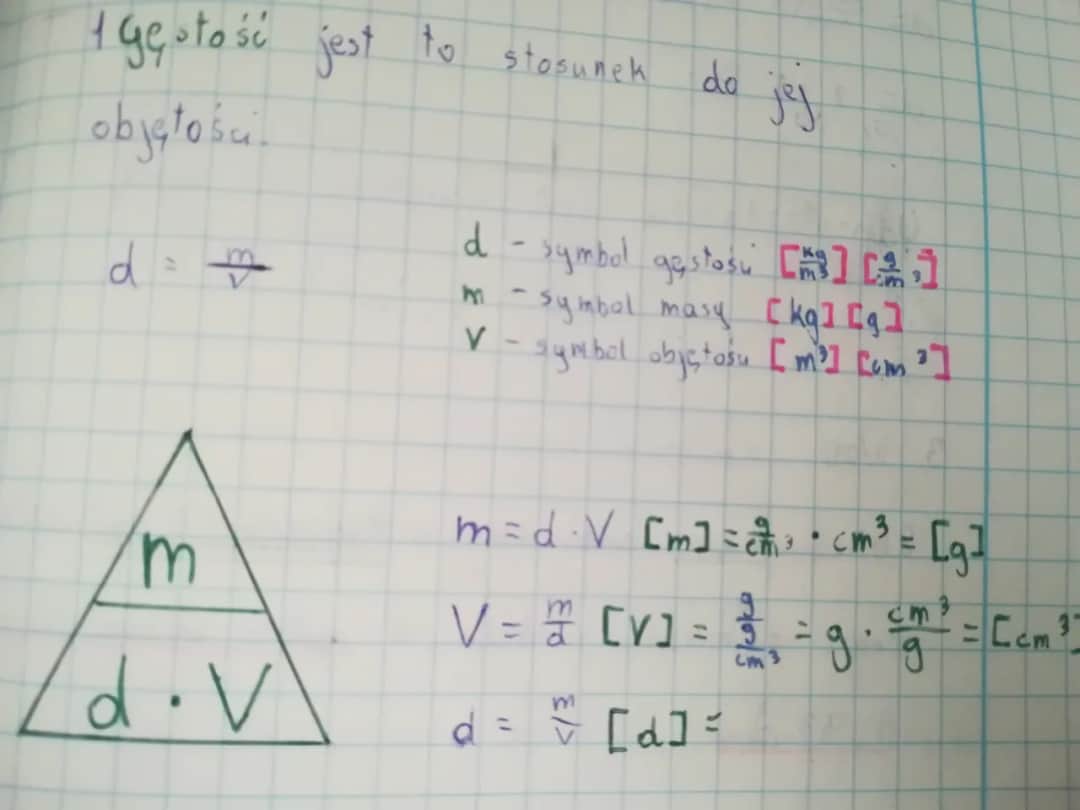Obliczanie objętości w chemii to kluczowa umiejętność, która znajduje zastosowanie w wielu dziedzinach, od reakcji chemicznych po analizę roztworów. Objętość to nie tylko podstawowa wielkość fizyczna, ale także ważny parametr w eksperymentach i obliczeniach chemicznych. W tym artykule dowiesz się, jak w prosty sposób obliczyć objętość gazów, roztworów oraz jak wykorzystać tę wiedzę w praktyce.
Bez względu na to, czy pracujesz z gazami, cieczami czy substancjami stałymi, zrozumienie zasad obliczania objętości jest niezbędne. Prawo Avogadra, stężenie molowe czy objętość molowa to pojęcia, które mogą wydawać się skomplikowane, ale dzięki praktycznym przykładom i wskazówkom staną się proste i zrozumiałe. Przedstawimy również najczęstsze błędy, które popełniają początkujący, oraz sposoby, jak ich uniknąć.
Jeśli chcesz poznać proste metody obliczania objętości i nauczyć się, jak zastosować je w rzeczywistych sytuacjach chemicznych, ten artykuł jest właśnie dla Ciebie. Przejdziemy przez podstawowe wzory, praktyczne przykłady i narzędzia, które ułatwią Ci pracę w laboratorium lub na zajęciach.
Najważniejsze informacje:- Objętość to kluczowy parametr w chemii, używany w reakcjach, analizie roztworów i gazów.
- Prawo Avogadra pozwala obliczyć objętość gazów w standardowych warunkach.
- Stężenie molowe jest niezbędne do obliczania objętości roztworów.
- Objętość molowa to stała wartość dla gazów w warunkach normalnych (22,4 dm³/mol).
- Praktyczne przykłady i wskazówki pomogą uniknąć błędów w obliczeniach.
Podstawowe pojęcia i wzory do obliczania objętości w chemii
Obliczanie objętości w chemii to podstawa wielu eksperymentów i analiz. Objętość to wielkość fizyczna, która określa przestrzeń zajmowaną przez substancję. W chemii najczęściej używamy wzorów takich jak objętość molowa czy stężenie molowe, które pozwalają precyzyjnie określić ilość substancji w roztworach lub gazach.
| Nazwa wzoru | Jednostka objętości | Warunki | Opis zastosowania |
|---|---|---|---|
| Objętość molowa | 22,4 dm³/mol | Warunki normalne | Stosowana do obliczeń objętości gazów |
| Stężenie molowe | mol/dm³ | Dowolne stężenie | Używane do obliczeń objętości roztworów |
| Prawo Avogadra | dm³/mol | Stała temperatura i ciśnienie | Pozwala obliczyć objętość gazów w reakcjach |
| Gęstość | g/cm³ | Dowolna substancja | Umożliwia przeliczenie masy na objętość |
Objętość gazów: prawo Avogadra i jego zastosowanie
Prawo Avogadra to jedno z najważniejszych praw w chemii gazów. Mówi ono, że w tych samych warunkach temperatury i ciśnienia, równe objętości gazów zawierają tę samą liczbę cząsteczek. Dzięki temu możemy łatwo obliczyć objętość gazów w reakcjach chemicznych.
Na przykład, jeśli w reakcji powstaje 1 mol gazu, jego objętość w warunkach normalnych wyniesie 22,4 dm³. To proste prawo pozwala przewidzieć, ile gazu powstanie w wyniku reakcji. W praktyce, obliczanie objętości gazów jest niezbędne w analizie spalin czy produkcji chemicznej.
Obliczanie objętości roztworów: stężenie molowe i jego znaczenie
Stężenie molowe to kluczowy parametr w chemii roztworów. Określa ono liczbę moli substancji rozpuszczonej w 1 dm³ roztworu. Aby obliczyć objętość roztworu, musisz znać jego stężenie oraz ilość substancji rozpuszczonej.
Oto kroki, które pomogą Ci w obliczeniach:
- Określ liczbę moli substancji rozpuszczonej.
- Podziel tę wartość przez stężenie molowe roztworu.
- Wynik to objętość roztworu w dm³.
Jak objętość wpływa na reakcje chemiczne?
Objętość odgrywa kluczową rolę w reakcjach chemicznych, zwłaszcza gdy mamy do czynienia z gazami. Zmiana objętości może wpłynąć na równowagę reakcji, a także na szybkość jej przebiegu. Na przykład, w reakcjach spalania, objętość gazów może się znacząco zwiększyć.
W praktyce, objętość molowa pozwala przewidzieć, ile produktów gazowych powstanie w wyniku reakcji. To szczególnie ważne w przemyśle chemicznym, gdzie precyzyjne obliczenia są niezbędne do optymalizacji procesów.
Czytaj więcej: Co można studiować po biol-chem? Najlepsze kierunki i perspektywy zawodowe
Praktyczne przykłady obliczeń objętości w chemii
Przykłady to najlepszy sposób, aby zrozumieć, jak działa obliczanie objętości w chemii. Poniżej przedstawiamy kilka typowych sytuacji, w których te obliczenia są niezbędne.
| Przykład | Dane wejściowe | Wzór | Wynik |
|---|---|---|---|
| Obliczanie objętości gazu | 2 mole gazu | V = n * 22,4 dm³/mol | 44,8 dm³ |
| Obliczanie objętości roztworu | 0,5 mol, stężenie 2 mol/dm³ | V = n / C | 0,25 dm³ |
| Obliczanie objętości z gęstości | Masa 100 g, gęstość 2 g/cm³ | V = m / ρ | 50 cm³ |
Pamiętaj, że dokładne pomiary są kluczem do precyzyjnych obliczeń. Zawsze upewnij się, że używasz odpowiednich jednostek i sprawdzaj warunki, w jakich przeprowadzasz obliczenia.
Najczęstsze błędy przy obliczaniu objętości i jak ich unikać
Błędy w obliczeniach objętości mogą prowadzić do poważnych nieporozumień w eksperymentach. Jednym z najczęstszych jest pomijanie warunków, w jakich przeprowadzane są pomiary. Na przykład, objętość molowa gazów zmienia się wraz z temperaturą i ciśnieniem, co często jest ignorowane.
Innym błędem jest niewłaściwe przeliczanie jednostek. Wielu początkujących zapomina, że 1 dm³ to 1000 cm³, co prowadzi do błędnych wyników. Aby uniknąć takich pomyłek, zawsze sprawdzaj jednostki i upewnij się, że są spójne. Warto też korzystać z gotowych wzorów, takich jak prawo Avogadra, które minimalizują ryzyko błędów.
Wskazówki i triki do precyzyjnego obliczania objętości

Precyzja w obliczeniach objętości to podstawa sukcesu w chemii. Zawsze używaj dokładnych przyrządów pomiarowych, takich jak cylindry miarowe czy pipety. Pamiętaj, że nawet mały błąd może wpłynąć na wynik całego eksperymentu.
Przed rozpoczęciem obliczeń zawsze sprawdź, czy znasz wszystkie niezbędne dane, takie jak masa, stężenie czy temperatura. To pozwoli uniknąć niepotrzebnych błędów i zaoszczędzi czas.
Jak wykorzystać objętość w eksperymentach chemicznych?
Objętość to kluczowy parametr w wielu eksperymentach chemicznych. Na przykład, w reakcjach syntezy, precyzyjne obliczenia objętości reagentów są niezbędne do uzyskania pożądanego produktu. W przypadku gazów, obliczanie objętości gazów pozwala przewidzieć, ile produktu powstanie w wyniku reakcji.
W eksperymentach z roztworami, objętość jest równie ważna. Używając stężenia molowego, możesz dokładnie określić, ile substancji rozpuszczonej znajduje się w roztworze. Pamiętaj jednak, że bezpieczeństwo jest priorytetem – zawsze pracuj w dobrze wentylowanym pomieszczeniu i używaj odpowiedniego sprzętu ochronnego.
Narzędzia i metody pomocne w obliczaniu objętości
Do precyzyjnego obliczania objętości w chemii potrzebne są odpowiednie narzędzia. Cylindry miarowe, pipety i biurety to podstawowe przyrządy, które pozwalają dokładnie odmierzyć objętość cieczy. W przypadku gazów, używa się gazometrów lub specjalnych komór reakcyjnych.
Oto lista najważniejszych narzędzi i ich zastosowań:
- Cylinder miarowy – do pomiaru objętości cieczy z dokładnością do 0,1 cm³.
- Pipeta – do precyzyjnego odmierzania małych objętości roztworów.
- Biureta – stosowana w miareczkowaniu do dokładnego dozowania reagentów.
- Gazometr – do pomiaru objętości gazów w warunkach laboratoryjnych.
Dlaczego objętość jest kluczowa w analizie chemicznej?
Objętość to jeden z najważniejszych parametrów w analizie chemicznej. Pozwala ona określić ilość substancji w roztworze lub gazie, co jest niezbędne do przeprowadzenia reakcji. Na przykład, w analizie jakościowej, precyzyjne obliczenia objętości są kluczowe do identyfikacji składników próbki.
W praktyce, objętość molowa i stężenie molowe są używane do obliczeń stechiometrycznych, które pozwalają przewidzieć wyniki reakcji. To szczególnie ważne w przemyśle chemicznym, gdzie każdy błąd może prowadzić do strat materiałowych i finansowych.
Dlaczego precyzja w obliczaniu objętości jest kluczowa?
Obliczanie objętości to podstawa wielu procesów chemicznych, od reakcji syntezy po analizę roztworów. Jak pokazano w artykule, nawet niewielkie błędy w pomiarach mogą prowadzić do poważnych konsekwencji, takich jak nieprawidłowe wyniki eksperymentów. Przykłady, takie jak prawo Avogadra czy stężenie molowe, ilustrują, jak ważne jest uwzględnianie warunków pomiarowych i dokładne przeliczanie jednostek.
Artykuł podkreśla również znaczenie odpowiednich narzędzi, takich jak cylindry miarowe, pipety czy gazometry. Te przyrządy nie tylko ułatwiają precyzyjne pomiary, ale także minimalizują ryzyko błędów. Objętość molowa i stężenie molowe to kluczowe pojęcia, które pozwalają na dokładne planowanie i przeprowadzanie reakcji chemicznych, co jest niezbędne zarówno w laboratorium, jak i w przemyśle.
Podsumowując, precyzja w obliczeniach objętości to nie tylko kwestia dokładności, ale także bezpieczeństwa i efektywności procesów chemicznych. Unikanie błędów, stosowanie odpowiednich narzędzi i zrozumienie podstawowych zasad, takich jak prawo Avogadra, to klucz do sukcesu w każdej analizie chemicznej.