Obliczanie wartościowości atomu centralnego w związkach chemicznych to kluczowy element zrozumienia chemii. Wartościowość określa zdolność atomu do tworzenia wiązań z innymi atomami, co jest istotne w procesach chemicznych. W tym artykule przedstawimy kilka prostych metod, które pozwolą na łatwe obliczenie wartościowości atomu centralnego, zarówno w prostych cząsteczkach, jak i w bardziej złożonych związkach.
Wartościowość można obliczyć na podstawie różnych zasad, takich jak suma ładunków atomowych czy analiza wzoru strukturalnego. Te metody pomogą w precyzyjnym określeniu wartościowości atomów, co jest niezbędne do zrozumienia ich zachowań w reakcjach chemicznych. Przyjrzymy się również przykładom, które zilustrują, jak zastosować te metody w praktyce.
Kluczowe informacje:
- Wartościowość atomu centralnego można obliczyć, stosując zasadę, że suma wartościowości wszystkich atomów w cząsteczce musi być równa zero, jeśli cząsteczka jest obojętna.
- Dla kwasów, wartościowość atomu centralnego można obliczyć za pomocą wzoru uwzględniającego liczbę atomów tlenu i wodoru.
- Analiza wzoru strukturalnego pomaga w określeniu wartościowości na podstawie liczby wiązań, które tworzy dany atom.
- W związkach kompleksowych wartościowość jonu centralnego uwzględnia ładunki ligandów i zewnętrznych jonów.
- Maksymalna wartościowość pierwiastka często odpowiada cyfrze jedności jego grupy w układzie okresowym.
Zrozumienie wartościowości atomu centralnego w chemii
Wartościowość atomu centralnego to kluczowy koncept w chemii, który odnosi się do zdolności atomu do tworzenia wiązań z innymi atomami. Wartościowość jest istotna, ponieważ determinuje, jak atomy łączą się w cząsteczki, co wpływa na ich właściwości chemiczne i fizyczne. Zrozumienie tego pojęcia jest niezbędne dla każdego, kto chce zgłębić tajniki chemii, ponieważ pozwala na przewidywanie, jak różne substancje będą reagować ze sobą.
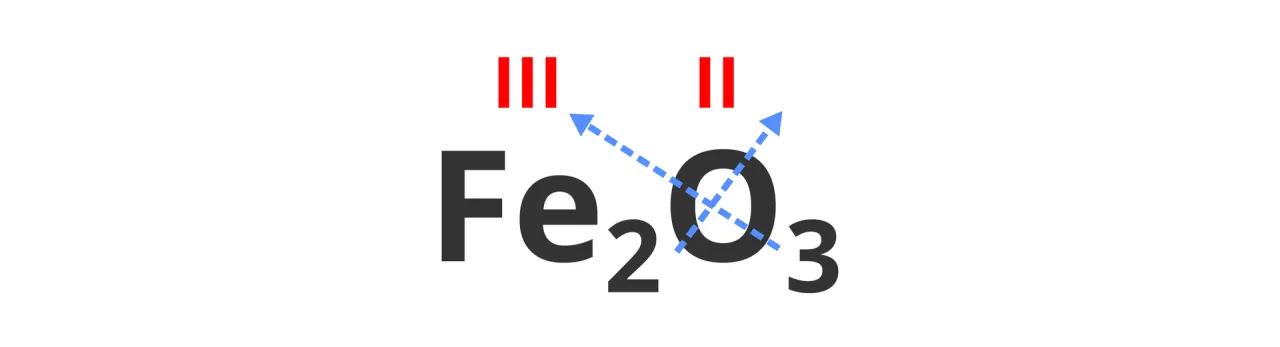
Aby lepiej zrozumieć wartościowość, warto zauważyć, że każdy atom ma swoją unikalną wartościowość, która jest związana z jego położeniem w układzie okresowym. Wartościowość atomu może się różnić w zależności od tego, w jakim związku się znajduje. Na przykład, w cząsteczce wody (H₂O) atom tlenu ma wartościowość II, co oznacza, że tworzy dwa wiązania z atomami wodoru. Zrozumienie wartościowości atomu centralnego jest kluczowe dla obliczania jego roli w związkach chemicznych.
Co to jest wartościowość i dlaczego jest ważna w chemii?
Wartościowość to liczba, która określa, ile wiązań chemicznych może utworzyć dany atom. Jest to fundamentalny parametr w chemii, który pozwala na określenie, jak atomy łączą się w cząsteczkach. Wartościowość jest ważna, ponieważ wpływa na stabilność i właściwości związków chemicznych. Na przykład, atomy węgla mają wartościowość IV, co pozwala im na tworzenie złożonych struktur, takich jak białka i kwasy nukleinowe, które są podstawą życia.
Jakie są podstawowe zasady obliczania wartościowości atomu?
Obliczanie wartościowości atomu centralnego opiera się na kilku fundamentalnych zasadach, które są kluczowe dla zrozumienia chemii. Wartościowość atomu można określić na podstawie jego stanów utlenienia, które wskazują, ile elektronów atom może oddać, przyjąć lub dzielić się z innymi atomami. Zasada ta jest niezbędna do przewidywania, jak atomy będą się łączyć w związkach chemicznych. Ważne jest, aby pamiętać, że suma wartościowości wszystkich atomów w cząsteczce musi być równa zero w przypadku związków obojętnych.
Inną istotną zasadą jest to, że każdy atom ma swoją maksymalną wartościowość, która często odpowiada liczbie elektronów w jego zewnętrznej powłoce. Na przykład, atomy grupy 1 mają maksymalną wartościowość równą 1, podczas gdy atomy grupy 17 mają wartościowość równą 1, gdyż mogą przyjąć jeden elektron. Zrozumienie tych zasad jest kluczowe dla każdego, kto chce obliczyć wartościowość atomu centralnego w różnych związkach chemicznych.
Metody obliczania wartościowości atomu centralnego w związkach chemicznych
Istnieje kilka metod, które można zastosować do obliczania wartościowości atomu centralnego w związkach chemicznych. Jedną z najczęściej stosowanych jest metoda summy ładunków, w której oblicza się wartościowość na podstawie sumy ładunków wszystkich atomów w cząsteczce. W przypadku związków obojętnych, suma ta powinna wynosić zero. Ta metoda jest szczególnie przydatna w przypadku prostych cząsteczek, gdzie łatwo można określić, jakie atomy są ze sobą połączone.
Kolejną metodą jest analiza wzoru strukturalnego, która polega na badaniu, jak atomy są ze sobą połączone i ile wiązań tworzy każdy atom. W tej metodzie atom centralny, który tworzy najwięcej wiązań, jest kluczowym elementem do obliczenia jego wartościowości. Analiza ta pozwala na wizualizację, jak atomy współdziałają w cząsteczce, co jest niezbędne do zrozumienia ich chemicznych właściwości.
Obliczanie wartościowości na podstawie sumy ładunków atomowych
Obliczanie wartościowości atomu centralnego na podstawie sumy ładunków atomowych to jedna z podstawowych metod w chemii. Wartościowość można określić, sumując ładunki wszystkich atomów w cząsteczce. W przypadku związków chemicznych, które są obojętne, suma ta powinna wynosić zero. Na przykład, jeśli cząsteczka zawiera atomy z różnymi ładunkami, wartościowość atomu centralnego można obliczyć, uwzględniając te ładunki. To podejście jest niezwykle przydatne w analizie złożonych związków chemicznych, gdzie różne atomy mają różne ładunki, co wpływa na ich interakcje.
Analiza wzoru strukturalnego dla określenia wartościowości
Analiza wzoru strukturalnego to kolejna metoda, która pozwala na określenie wartościowości atomu centralnego. W tej metodzie bada się, jak atomy są ze sobą połączone i ile wiązań tworzy każdy atom w cząsteczce. Wzór strukturalny ujawnia, które atomy są centralnymi w danym związku i jaką mają wartościowość na podstawie liczby utworzonych wiązań. Wartościowość atomu centralnego można zatem określić, obserwując, jakie inne atomy są z nim połączone oraz jaką mają one wartościowość. Ta metoda jest szczególnie użyteczna w przypadku złożonych cząsteczek, gdzie interakcje między atomami są kluczowe dla zrozumienia ich właściwości chemicznych.
Przykłady obliczeń wartościowości atomu centralnego w różnych związkach
Wartościowość atomu centralnego można obliczyć w wielu związkach chemicznych, co pozwala lepiej zrozumieć ich właściwości i zachowanie. Na przykład, w cząsteczce wody (H₂O), atom tlenu ma wartościowość II, ponieważ tworzy dwa wiązania z atomami wodoru. W przypadku amoniaku (NH₃), azot ma wartościowość III, ponieważ łączy się z trzema atomami wodoru. Te przykłady ilustrują, jak wartościowość atomu centralnego wpływa na strukturę i stabilność cząsteczek.
W bardziej złożonych związkach, takich jak siarczan(VI) sodu (Na₂SO₄), wartościowość atomu centralnego, czyli siarki, wynosi VI. Siarka w tym przypadku łączy się z czterema atomami tlenu, co pokazuje, jak wartościowość wpływa na formowanie złożonych struktur chemicznych. Wartościowość atomów w tych związkach jest kluczowa dla ich reaktywności i właściwości fizycznych.
| Związek chemiczny | Wartościowość atomu centralnego |
|---|---|
| H₂O (woda) | II (tlenu) |
| NH₃ (amoniak) | III (azotu) |
| Na₂SO₄ (siarczan(VI) sodu) | VI (siarki) |
Obliczenia wartościowości w prostych cząsteczkach chemicznych
W prostych cząsteczkach chemicznych obliczanie wartościowości atomu centralnego jest stosunkowo łatwe. Na przykład, w cząsteczce dwutlenku węgla (CO₂), węgiel ma wartościowość IV, ponieważ tworzy dwa podwójne wiązania z dwoma atomami tlenu. W cząsteczce metanu (CH₄), wartościowość węgla wynosi IV, co oznacza, że łączy się z czterema atomami wodoru. Te proste przykłady pokazują, jak różne atomy mogą mieć różne wartościowości, co wpływa na ich właściwości chemiczne i fizyczne.
Wartościowość atomu centralnego w związkach kompleksowych
W związkach kompleksowych wartościowość atomu centralnego jest kluczowym czynnikiem, który wpływa na właściwości chemiczne całego związku. Na przykład w kompleksie chlorku miedzi(II) (CuCl₂), miedź ma wartościowość II, ponieważ łączy się z dwoma atomami chloru. Innym przykładem jest kompleks amonowy (NH₄⁺), w którym azot ma wartościowość III, ponieważ łączy się z czterema atomami wodoru, tworząc dodatnio naładowany jon. W przypadku złota(III) bromku (AuBr₄⁻), złoto ma wartościowość III, co oznacza, że tworzy cztery wiązania z bromem, a całkowity ładunek jonu wynosi -1.
Wartościowość atomu centralnego w związkach kompleksowych można również określić na podstawie ładunków ligandów. Na przykład w kompleksie potasu tetrachlorozłotego (K[AuCl₄]), potas ma wartościowość I, a cztery jony chloru mają łączny ładunek -4, co oznacza, że złoto (Au) ma wartościowość III. Te przykłady ilustrują, jak różne wartościowości atomów centralnych w związkach kompleksowych wpływają na ich właściwości chemiczne i stabilność.
Częste błędy i nieporozumienia przy obliczaniu wartościowości
Podczas obliczania wartościowości atomu centralnego, wiele osób popełnia powszechne błędy, które mogą prowadzić do nieprawidłowych wyników. Jednym z najczęstszych błędów jest nieprawidłowe zrozumienie zasady, że suma wartościowości wszystkich atomów w cząsteczce musi być równa zero w przypadku związków obojętnych. Często zdarza się, że uczniowie nie uwzględniają ładunków ligandów w obliczeniach, co prowadzi do błędnych wniosków o wartościowości atomu centralnego. Aby uniknąć tych pomyłek, ważne jest, aby zawsze dokładnie analizować struktury chemiczne i ładunki atomowe.
Innym częstym nieporozumieniem jest mylenie wartościowości z innymi pojęciami, takimi jak stopień utlenienia. Wartościowość odnosi się do zdolności atomu do tworzenia wiązań, podczas gdy stopień utlenienia określa, jak atom jest naładowany w danym związku. Zrozumienie różnicy między tymi pojęciami jest kluczowe dla prawidłowego obliczania wartościowości. Warto również pamiętać, że niektóre pierwiastki mogą mieć różne wartościowości w różnych związkach, co może prowadzić do dalszych nieporozumień. Dlatego ważne jest, aby zawsze odnosić się do układu okresowego i dobrze zrozumieć właściwości chemiczne pierwiastków.
Praktyczne zastosowania wartościowości w chemii i materiałach
Wartościowość atomu centralnego ma kluczowe znaczenie nie tylko w teorii chemii, ale także w praktycznych zastosowaniach, takich jak projektowanie nowych materiałów i reakcji chemicznych. Na przykład, w inżynierii materiałowej, zrozumienie wartościowości atomów pozwala na tworzenie zaawansowanych materiałów kompozytowych, które mogą mieć unikalne właściwości mechaniczne i chemiczne. Stosując odpowiednie wartościowości, chemicy mogą syntetyzować nowe związki, które są bardziej odporne na korozję lub mają lepsze właściwości przewodzące.
Dodatkowo, w kontekście zrównoważonego rozwoju, znajomość wartościowości atomów jest kluczowa w procesach takich jak recykling i usuwanie zanieczyszczeń. Chemicy mogą projektować reakcje, które skutecznie eliminują toksyczne metale ciężkie z wód gruntowych, wykorzystując ich wartościowość do tworzenia stabilnych kompleksów. W miarę jak technologia się rozwija, zrozumienie wartościowości atomów będzie coraz bardziej istotne w opracowywaniu innowacyjnych rozwiązań dla wyzwań ekologicznych i przemysłowych.