Dysocjacja w chemii to kluczowy proces, który pozwala zrozumieć, jak substancje rozpadają się na jony lub mniejsze cząsteczki. Zachodzi najczęściej w roztworach, gdzie związki chemiczne rozdzielają się na kationy i aniony. Ten proces jest szczególnie istotny dla elektrolitów, takich jak kwasy, zasady i sole, które odgrywają ważną rolę w wielu reakcjach chemicznych.
W wyniku dysocjacji substancje mogą zmieniać swoje właściwości, co ma znaczenie w różnych dziedzinach nauki i technologii. Zrozumienie tego procesu pomaga nie tylko w chemii, ale także w biologii i medycynie, gdzie dysocjacja wpływa na reakcje biologiczne i funkcje komórkowe.
Kluczowe informacje:- Dysocjacja to proces rozpadu substancji na jony pod wpływem różnych czynników.
- Najczęściej występuje w roztworach, gdzie substancje dzielą się na kationy i aniony.
- Dysocjacja elektrolityczna jest istotna dla kwasów, zasad i soli.
- Kwasy dysocjują na kationy wodoru (H+) i aniony reszty kwasowej.
- Dysocjacja jest procesem odwracalnym, co oznacza, że istnieje równowaga między formą zdysocjowaną a niezdysocjowaną.
Zrozumienie dysocjacji: definicja i kluczowe pojęcia
Dysocjacja to proces chemiczny, który polega na rozpadowi substancji na jony lub mniejsze cząsteczki. Zachodzi głównie w roztworach, gdzie substancje dzielą się na kationy i aniony. Zrozumienie tego procesu jest kluczowe dla analizy właściwości roztworów elektrolitów oraz reakcji chemicznych, które mają miejsce w wodzie.
W chemii wyróżniamy różne typy dysocjacji, w tym dysocjację elektrolityczną, która zachodzi w obecności wody. Jest to istotne dla kwasów, zasad i soli, które w trakcie dysocjacji zmieniają swoje właściwości. Przykładowo, kwasy dysocjują na kationy wodoru (H+) oraz aniony reszty kwasowej, co ma wpływ na ich zachowanie w roztworze.
Co to jest dysocjacja? Wyjaśnienie podstawowych terminów
Dysocjacja to proces, w którym substancje chemiczne ulegają rozkładowi na mniejsze jednostki. Może zachodzić na różne sposoby, w zależności od rodzaju substancji i warunków, w jakich się znajduje. Na przykład, w przypadku kwasów, proces ten prowadzi do uwolnienia kationów wodoru, co wpływa na pH roztworu. Warto zauważyć, że dysocjacja jest procesem odwracalnym, co oznacza, że substancje mogą wrócić do swojej pierwotnej formy.
W chemii wyróżniamy dwa główne typy dysocjacji: dysocjację całkowitą i dysocjację częściową. W dysocjacji całkowitej wszystkie cząsteczki substancji rozdzielają się na jony, natomiast w dysocjacji częściowej tylko część cząsteczek ulega rozkładowi. To zróżnicowanie ma kluczowe znaczenie dla zrozumienia, jak różne substancje zachowują się w roztworach.
Jakie substancje ulegają dysocjacji? Przykłady z życia codziennego
Dysocjacja jest zjawiskiem, które możemy zaobserwować w wielu substancjach, z którymi mamy do czynienia na co dzień. Przykładem są kwasy, takie jak kwas solny (HCl), który w wodzie dysocjuje na kationy H+ i aniony Cl-. Właśnie dlatego kwas solny jest silnym elektrolitem, wpływającym na przewodnictwo elektryczne roztworu. Innym przykładem są sole, na przykład chlorek sodu (NaCl), który w wodzie również ulega dysocjacji. Rozdziela się na kationy Na+ i aniony Cl-, co jest kluczowe dla wielu procesów biologicznych, takich jak regulacja ciśnienia osmotycznego w komórkach. Warto również wspomnieć o zasadach, takich jak wodorotlenek sodu (NaOH), który dysocjuje na jony Na+ i OH-, co wpływa na pH roztworu.- Kwas solny (HCl) - dysocjuje na H+ i Cl-.
- Chlorek sodu (NaCl) - dysocjuje na Na+ i Cl-.
- Wodorotlenek sodu (NaOH) - dysocjuje na Na+ i OH-.
Rola dysocjacji w chemii: znaczenie dla roztworów
Dysocjacja odgrywa kluczową rolę w chemii, zwłaszcza w kontekście roztworów. To właśnie dzięki temu procesowi substancje chemiczne mogą oddziaływać ze sobą w formie jonów. W roztworach elektrolitów, takich jak kwasy, zasady i sole, dysocjacja wpływa na ich właściwości oraz zachowanie w różnych warunkach. Bez tego procesu wiele reakcji chemicznych byłoby niemożliwych.
Właściwości roztworów, w których zachodzi dysocjacja elektrolityczna, są różne od tych, które nie ulegają dysocjacji. Na przykład, roztwory elektrolitów mają zdolność przewodzenia prądu elektrycznego, co jest wynikiem obecności swobodnych jonów. To zjawisko jest kluczowe w wielu zastosowaniach, od procesów biologicznych po przemysł chemiczny.
Dlaczego dysocjacja jest istotna w roztworach elektrolitów?
Dysocjacja jest niezwykle istotna w roztworach elektrolitów, ponieważ umożliwia powstawanie jonów, które są niezbędne do przeprowadzania wielu reakcji chemicznych. Elektrolity, takie jak NaCl, rozdzielają się na kationy i aniony, co pozwala na ich aktywne uczestnictwo w procesach chemicznych. Bez dysocjacji, wiele z tych reakcji nie mogłoby się odbyć, co wpływałoby na funkcjonowanie organizmów żywych oraz procesy przemysłowe.
Na przykład, w organizmach żywych, elektrolity odgrywają kluczową rolę w przewodnictwie nerwowym oraz regulacji ciśnienia osmotycznego. Kiedy jony przemieszcza się przez błony komórkowe, stają się one niezbędne dla utrzymania równowagi wewnętrznej. Dlatego zrozumienie dysocjacji i jej znaczenia w roztworach elektrolitów jest kluczowe dla biologii i medycyny.
Jak dysocjacja wpływa na reakcje chemiczne w wodzie?
Dysocjacja ma znaczący wpływ na reakcje chemiczne, które zachodzą w wodzie. Woda, jako rozpuszczalnik, umożliwia rozdzielenie cząsteczek na jony, co z kolei prowadzi do powstawania nowych substancji. W przypadku reakcji chemicznych, w których uczestniczą kwasy i zasady, dysocjacja jest kluczowym krokiem, który wpływa na przebieg reakcji oraz jej produkty.
Na przykład, w reakcji kwasu solnego z wodorotlenkiem sodu, dysocjacja obu substancji prowadzi do powstania wody i soli. W tym przypadku, obecność jonów H+ i OH- jest niezbędna do zajścia reakcji. Równowaga między dysocjacją a rekombinacją jonów wpływa na to, jak szybko zachodzi dana reakcja oraz jakie są jej końcowe produkty.
| Rodzaj reakcji | Reakcje w roztworach dysocjujących | Reakcje w roztworach niedysocjujących |
| Przykład 1 | Kwas solny + Wodorotlenek sodu → Sól + Woda | Brak reakcji |
| Przykład 2 | Woda + NaCl → Na+ + Cl- | Brak dysocjacji |
Czytaj więcej: Co to jest katalizator w chemii i jak wpływa na reakcje? Proste wyjaśnienie
Proces dysocjacji: jak zachodzi i co go wpływa?
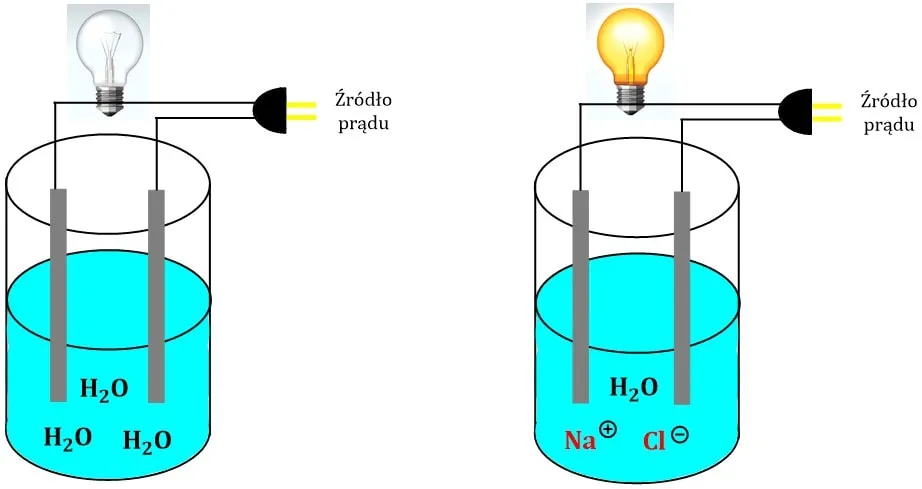 Dysocjacja to proces chemiczny, który zachodzi, gdy substancje rozdzielają się na jony lub mniejsze cząsteczki. Ten proces jest kluczowy dla zrozumienia, jak różne substancje zachowują się w roztworach. W przypadku dysocjacji elektrolitycznej, czynniki takie jak temperatura, stężenie i rodzaj rozpuszczalnika mają istotny wpływ na to, jak szybko i w jakim stopniu zachodzi ten proces.
Dysocjacja to proces chemiczny, który zachodzi, gdy substancje rozdzielają się na jony lub mniejsze cząsteczki. Ten proces jest kluczowy dla zrozumienia, jak różne substancje zachowują się w roztworach. W przypadku dysocjacji elektrolitycznej, czynniki takie jak temperatura, stężenie i rodzaj rozpuszczalnika mają istotny wpływ na to, jak szybko i w jakim stopniu zachodzi ten proces.
Warto zauważyć, że dysocjacja jest procesem odwracalnym, co oznacza, że jony mogą się łączyć, tworząc pierwotne cząsteczki. Zrozumienie mechanizmu dysocjacji jest kluczowe dla chemików, ponieważ wpływa na wiele reakcji chemicznych oraz ich produkty końcowe.
Czym jest dysocjacja elektrolityczna? Zrozumienie mechanizmu
Dysocjacja elektrolityczna to proces, w którym substancje rozdzielają się na jony pod wpływem rozpuszczalnika, najczęściej wody. Przykładem może być sól kuchenna (NaCl), która w wodzie dysocjuje na kationy sodu (Na+) i aniony chlorkowe (Cl-). Ta forma dysocjacji jest niezwykle ważna, ponieważ umożliwia przewodzenie prądu elektrycznego w roztworach.
Mechanizm dysocjacji elektrolitycznej polega na tym, że cząsteczki wody otaczają jony, stabilizując je i ułatwiając ich oddzielanie. Woda, jako rozpuszczalnik, ma unikalne właściwości, które pozwalają na skuteczne rozdzielanie jonów. Dzięki temu, substancje takie jak kwasy, zasady i sole mogą funkcjonować w roztworach, co jest kluczowe dla wielu reakcji chemicznych.
Jakie czynniki wpływają na stopień dysocjacji substancji?
Stopień dysocjacji substancji zależy od wielu czynników, w tym temperatury, stężenia oraz rodzaju rozpuszczalnika. Wzrost temperatury często zwiększa stopień dysocjacji, ponieważ cząsteczki poruszają się szybciej i mają większą energię. Na przykład, w przypadku kwasu octowego (CH3COOH), wyższa temperatura prowadzi do większej dysocjacji na jony H+ i CH3COO-.
Stężenie roztworu również ma znaczenie. W roztworach o niskim stężeniu, dysocjacja jest bardziej wyraźna, ponieważ jony mają więcej miejsca do poruszania się. Z kolei w roztworach o wysokim stężeniu, jony mogą oddziaływać ze sobą, co ogranicza dalszą dysocjację. Rodzaj rozpuszczalnika również wpływa na proces dysocjacji; na przykład, niektóre substancje dysocjują lepiej w wodzie niż w innych rozpuszczalnikach organicznych.
Kluczowe czynniki wpływające na dysocjację substancji chemicznych
Dysocjacja substancji chemicznych jest procesem, który zależy od wielu czynników, takich jak temperatura, stężenie i rodzaj rozpuszczalnika. W artykule omówiono, jak wyższa temperatura może zwiększać stopień dysocjacji, co ilustruje przykład kwasu octowego (CH3COOH), który w wyższej temperaturze dysocjuje na jony H+ i CH3COO-. Warto zauważyć, że w roztworach o niskim stężeniu, dysocjacja jest bardziej wyraźna, ponieważ jony mają więcej miejsca do poruszania się, co wpływa na ich interakcje.
Oprócz temperatury, rodzaj rozpuszczalnika ma kluczowe znaczenie dla procesu dysocjacji. Na przykład, niektóre substancje lepiej dysocjują w wodzie niż w innych rozpuszczalnikach organicznych. Zrozumienie tych czynników jest istotne dla chemików, ponieważ wpływa na przebieg wielu reakcji chemicznych oraz ich produkty końcowe, co pokazuje, jak ważna jest dysocjacja w kontekście reakcji chemicznych w wodzie.

