Alkohol w chemii to ważna grupa związków organicznych, które mają kluczowe znaczenie w wielu dziedzinach nauki i przemysłu. W swojej podstawowej definicji, alkohol to związek, w którym atom wodoru został zastąpiony przez grupę hydroksylową (-OH). To właśnie ta struktura sprawia, że alkohole mają unikalne właściwości chemiczne i fizyczne, które są istotne zarówno w laboratoriach, jak i w codziennym życiu.
Wśród najpopularniejszych alkoholi znajdują się etanol, znany jako alkohol etylowy, oraz metanol, zwany alkoholem metylowym. Oba te związki różnią się nie tylko właściwościami, ale również zastosowaniem. Etanol jest szeroko stosowany jako rozpuszczalnik i składnik napojów alkoholowych, podczas gdy metanol, ze względu na swoją toksyczność, znajduje zastosowanie głównie w przemyśle. W artykule przyjrzymy się bliżej strukturze, rodzajom oraz właściwościom alkoholi, aby lepiej zrozumieć ich rolę w chemii.
Kluczowe informacje:- Alkohol to związek organiczny, w którym atom wodoru jest zastąpiony grupą hydroksylową (-OH).
- Wzór ogólny alkoholi to CnH2n+1OH, gdzie n oznacza liczbę atomów węgla.
- Alkohole dzielą się na trzy grupy: pierwszorzędowe, drugorzędowe i trzeciorzędowe.
- Etanol jest używany jako rozpuszczalnik i składnik napojów, a metanol jest toksyczny i stosowany w przemyśle.
- Alkohole krótkocząsteczkowe dobrze rozpuszczają się w wodzie, podczas gdy dłuższe łańcuchy węglowe mają mniejszą rozpuszczalność.
- Alkohole reagują z aktywnymi metalami, tworząc alkoholany i wydzielając wodór.
Co to jest alkohol w chemii? Definicja i podstawowe informacje
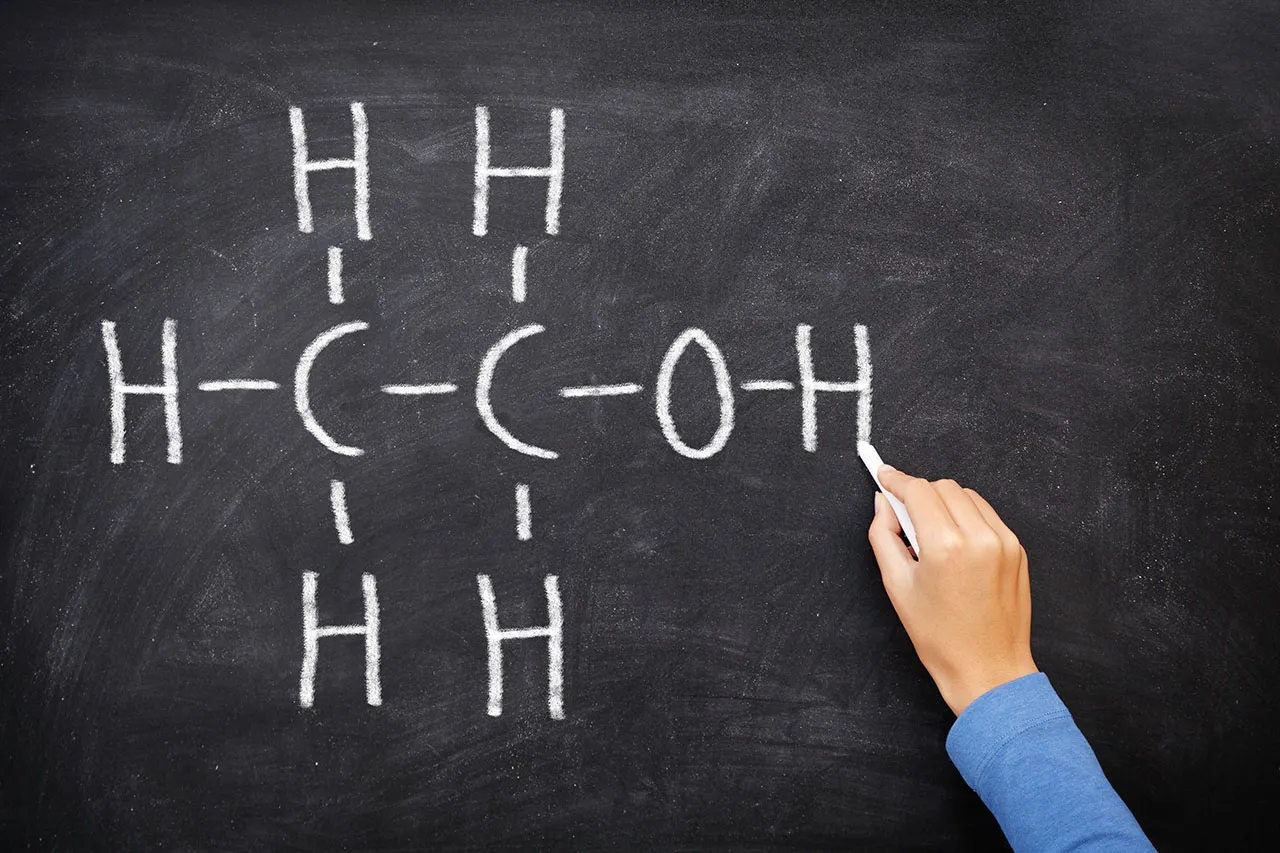
Alkohol w chemii to grupa związków organicznych, które są pochodnymi węglowodorów. W tych związkach jeden atom wodoru został zastąpiony przez grupę hydroksylową (-OH). To właśnie ta zmiana nadaje alkoholom ich charakterystyczne właściwości chemiczne.
Wzór ogólny alkoholi to CnH2n+1OH, gdzie n oznacza liczbę atomów węgla w cząsteczce. Alkohole są niezwykle ważne w różnych dziedzinach, od przemysłu chemicznego po farmaceutyki. Warto zauważyć, że alkohole można podzielić na trzy główne grupy: pierwszorzędowe, drugorzędowe i trzeciorzędowe, co ma istotne znaczenie dla ich właściwości i zastosowań.Struktura chemiczna alkoholu: Jak wygląda cząsteczka?
Alkohole mają zróżnicowaną strukturę chemiczną, co wpływa na ich właściwości. Ogólny wzór CnH2n+1OH pokazuje, że każda cząsteczka alkoholu zawiera grupę hydroksylową, która jest odpowiedzialna za ich charakterystyczne cechy. Na przykład, w przypadku etanolu, który jest najpopularniejszym alkoholem, cząsteczka składa się z dwóch atomów węgla, sześciu atomów wodoru i jednej grupy hydroksylowej.
Układ atomów w cząsteczce alkoholu wpływa na jego właściwości fizyczne, takie jak rozpuszczalność w wodzie czy temperatura wrzenia. Alkohole o krótkich łańcuchach węglowych, takie jak metanol czy etanol, są dobrze rozpuszczalne w wodzie, podczas gdy dłuższe łańcuchy węglowe, jak w przypadku heksanolu, mają mniejszą rozpuszczalność. Warto zauważyć, że struktura alkoholu wpływa również na jego reaktywność.
Czytaj więcej: Czym jest emulsja w chemii? Definicja, przykłady i zastosowania w prosty sposób
Rodzaje alkoholi: Zrozumienie różnic między nimi
Alkohole można podzielić na trzy główne kategorie w zależności od położenia grupy hydroksylowej: pierwszorzędowe, drugorzędowe i trzeciorzędowe. Każdy z tych typów ma swoje unikalne cechy i zastosowania. Alkohole pierwszorzędowe mają grupę hydroksylową przy atomie węgla, który jest połączony z jednym innym atomem węgla. Przykładem jest etanol.
- Alkohole pierwszorzędowe: Przykład - etanol, używany w napojach alkoholowych.
- Alkohole drugorzędowe: Przykład - izopropanol, stosowany jako środek dezynfekujący.
- Alkohole trzeciorzędowe: Przykład - tert-butanol, używany w syntezach chemicznych.
Rodzaje alkoholi: Zrozumienie różnic między nimi
Alkohole dzielą się na trzy główne kategorie: alkohole pierwszorzędowe, alkohole drugorzędowe oraz alkohole trzeciorzędowe. Każdy z tych typów ma unikalne cechy, które wpływają na ich właściwości chemiczne oraz zastosowania. Warto zrozumieć, jak różnice w strukturze wpływają na funkcje tych związków w chemii.
Alkohole pierwszorzędowe: Cechy i przykłady
Alkohole pierwszorzędowe to związki, w których grupa hydroksylowa (-OH) jest przyłączona do atomu węgla, który jest połączony z tylko jednym innym atomem węgla. Przykładem jest etanol, znany jako alkohol etylowy, który jest szeroko stosowany w napojach alkoholowych oraz jako rozpuszczalnik w przemyśle chemicznym. Inne przykłady to propan-1-ol, używany w produkcji kosmetyków oraz butanol, który znajduje zastosowanie w przemyśle farmaceutycznym.
Alkohole drugorzędowe: Czym się różnią?
Alkohole drugorzędowe mają grupę hydroksylową przyłączoną do atomu węgla, który jest połączony z dwoma innymi atomami węgla. Przykładem alkoholu drugorzędowego jest izopropanol, znany również jako alkohol izopropylowy, który jest popularnym środkiem dezynfekującym. Inne przykłady to butan-2-ol, stosowany w produkcji chemikaliów, oraz pentan-2-ol, który jest używany w przemyśle kosmetycznym.Alkohole trzeciorzędowe: Właściwości i zastosowania
Alkohole trzeciorzędowe charakteryzują się tym, że grupa hydroksylowa jest przyłączona do atomu węgla, który jest połączony z trzema innymi atomami węgla. Przykładem alkoholu trzeciorzędowego jest tert-butanol, który znajduje zastosowanie w syntezach chemicznych oraz jako rozpuszczalnik. Inne przykłady to 2-metylo-2-butanol, używany w produkcji farb, oraz 2-pentanol, który ma zastosowanie w przemyśle farmaceutycznym.
Właściwości alkoholi: Co je wyróżnia w chemii?
Alkohole charakteryzują się unikalnymi właściwościami chemicznymi i fizycznymi, które mają kluczowe znaczenie dla ich zastosowania. Jednym z najważniejszych aspektów jest rozpuszczalność alkoholi w wodzie. Alkohole o krótkich łańcuchach węglowych, takie jak etanol i metanol, dobrze rozpuszczają się w wodzie, co czyni je przydatnymi w wielu procesach chemicznych. Z drugiej strony, alkohole z dłuższymi łańcuchami węglowymi, jak heksanol, mają ograniczoną rozpuszczalność, co wpływa na ich zastosowanie w różnych dziedzinach.
Kolejną istotną cechą jest temperatura wrzenia. Alkohole mają wyższe temperatury wrzenia niż odpowiadające im węglowodory, co wynika z obecności wiązań wodorowych między cząsteczkami alkoholu. Na przykład, etanol wrze w temperaturze 78,37°C, podczas gdy jego odpowiednik, etan, wrze w -88,6°C. Reaktywność alkoholi również jest różna; alkohole pierwszorzędowe i drugorzędowe mogą ulegać utlenieniu, podczas gdy alkohole trzeciorzędowe są bardziej stabilne i nie ulegają utlenieniu w standardowych warunkach.
Zastosowanie alkoholi: Gdzie znajdują zastosowanie w praktyce?
Alkohole mają szerokie zastosowanie w różnych branżach. W przemyśle chemicznym są wykorzystywane jako rozpuszczalniki oraz surowce do syntez. Na przykład, etanol jest powszechnie stosowany w produkcji napojów alkoholowych oraz jako rozpuszczalnik w farbach i kosmetykach. Metanol, mimo swojej toksyczności, znajduje zastosowanie w produkcji formaldehydu oraz jako rozpuszczalnik w przemyśle chemicznym.
W farmaceutyce alkohole pełnią kluczową rolę jako składniki aktywne w lekach oraz jako rozpuszczalniki w procesach ekstrakcji. Izopropanol jest często stosowany jako środek dezynfekujący, a etanol jest używany w produkcji wielu leków. W codziennym życiu alkohole są obecne w produktach higienicznych, takich jak płyny do dezynfekcji rąk.
| Alkohol | Zastosowanie |
| Etanol | Rozpuszczalnik, składnik napojów alkoholowych |
| Metanol | Produkcja formaldehydu, rozpuszczalnik |
| Izopropanol | Środek dezynfekujący |
Reakcje chemiczne alkoholi: Jak reagują z innymi substancjami?
Alkohole uczestniczą w wielu ważnych reakcjach chemicznych. Jednym z kluczowych procesów jest utlenienie, w którym alkohole pierwszorzędowe i drugorzędowe ulegają przekształceniu w aldehydy, ketony lub kwasy karboksylowe. Na przykład, etanol może zostać utleniony do aldehydu octowego, co jest istotne w produkcji octu. W przypadku alkoholi trzeciorzędowych, które są bardziej stabilne, reakcja utlenienia nie zachodzi w standardowych warunkach.
Kolejną istotną reakcją jest esterifikacja, w której alkohol reaguje z kwasem, tworząc ester i wodę. Przykładem jest reakcja etanolu z kwasem octowym, która prowadzi do powstania octanu etylu, używanego w przemyśle spożywczym i kosmetycznym. Alkohole również reagują z aktywnymi metalami, takimi jak sód, tworząc alkoholany i wydzielając wodór.
- Utlenienie: Alkohole pierwszorzędowe i drugorzędowe ulegają utlenieniu do aldehydów i ketonów.
- Esterifikacja: Reakcja alkoholu z kwasem prowadzi do powstania estrów.
- Reakcje z metalami: Alkohole reagują z metalami, tworząc alkoholany.
Alkohole: Kluczowe właściwości, zastosowania i reakcje chemiczne
Alkohole to grupa związków organicznych o unikalnych właściwościach chemicznych i fizycznych, które mają kluczowe znaczenie w różnych dziedzinach. Ich rozpuszczalność w wodzie oraz wyższe temperatury wrzenia w porównaniu do węglowodorów sprawiają, że są one wykorzystywane jako rozpuszczalniki w przemyśle chemicznym i farmaceutycznym. Przykłady zastosowań obejmują etanol, który jest nie tylko składnikiem napojów alkoholowych, ale również rozpuszczalnikiem w kosmetykach, oraz izopropanol, powszechnie stosowany jako środek dezynfekujący.
Dodatkowo, alkohole uczestniczą w istotnych reakcjach chemicznych, takich jak utlenienie i esterifikacja. Utlenienie alkoholi pierwszorzędowych i drugorzędowych prowadzi do powstania aldehydów i ketonów, co jest kluczowe w wielu procesach przemysłowych. Esterifikacja, z kolei, umożliwia tworzenie estrów, które są wykorzystywane w przemyśle spożywczym i kosmetycznym. Zrozumienie tych właściwości i reakcji jest niezbędne dla efektywnego wykorzystania alkoholi w praktyce.