Dipol w chemii to termin, który odnosi się do cząsteczek posiadających bieguny dodatnie i ujemne. Przykładem takiej cząsteczki jest woda (H₂O), gdzie atomy wodoru mają ładunek ujemny, a atom tlenu ładunek dodatni. Dzięki nierównomiernemu podziałowi elektronów w cząsteczce, powstaje moment dipolowy, który odgrywa kluczową rolę w zrozumieniu interakcji chemicznych.
W artykule przyjrzymy się bliżej, czym dokładnie jest dipol, jakie ma właściwości oraz jakie znaczenie ma w chemii. Zrozumienie tych aspektów pomoże lepiej pojąć, jak dipole wpływają na reakcje chemiczne i właściwości różnych substancji.
Kluczowe informacje:- Dipol to cząsteczka z biegunami dodatnim i ujemnym, np. cząsteczka wody.
- Moment dipolowy jest wynikiem nierównomiernego podziału elektronów w cząsteczce.
- Bieguny cząsteczki mają wpływ na jej właściwości fizyczne, takie jak rozpuszczalność i temperatura wrzenia.
- Dipole odgrywają ważną rolę w interakcjach chemicznych, w tym w tworzeniu wiązań chemicznych.
- Przykłady innych cząsteczek dipolowych obejmują amoniak (NH₃) i chlorowodór (HCl).
Co to jest dipol w chemii? Kluczowe definicje i przykłady
Dipol w chemii to cząsteczka z biegunami dodatnim i ujemnym. Przykładem takiego dipolu jest cząsteczka wody (H₂O), w której atomy wodoru mają ładunek ujemny, a atom tlenu ładunek dodatni. W wyniku nierównomiernego podziału elektronów w cząsteczce, powstaje moment dipolowy, co ma kluczowe znaczenie dla zrozumienia interakcji chemicznych. W chemii, dipole są istotne, ponieważ wpływają na właściwości substancji, takie jak rozpuszczalność i temperatura wrzenia. Zrozumienie tego zjawiska pozwala lepiej pojąć, jak różne cząsteczki oddziałują ze sobą. Dzięki analizie dipoli, możemy przewidzieć, jak będą się zachowywać różne cząsteczki polarne w różnych warunkach.W chemii, dipole są istotne, ponieważ wpływają na właściwości substancji, takie jak rozpuszczalność i temperatura wrzenia. Zrozumienie tego zjawiska pozwala lepiej pojąć, jak różne cząsteczki oddziałują ze sobą. Dzięki analizie dipoli, możemy przewidzieć, jak będą się zachowywać różne cząsteczki polarne w różnych warunkach.Czym są bieguny dodatnie i ujemne w cząsteczkach?
Bieguny dodatnie i ujemne w cząsteczkach to wyniki nierównomiernego rozkładu ładunków elektrycznych. W cząsteczkach, gdzie atomy mają różną elektroujemność, dochodzi do przesunięcia elektronów, co prowadzi do powstania częściowego ładunku dodatniego na jednym końcu i częściowego ładunku ujemnego na drugim. Na przykład, w cząsteczce wody, atom tlenu przyciąga elektrony silniej niż atomy wodoru, co tworzy dipol.
Przykładem innej cząsteczki dipolowej jest amoniak (NH₃). W amoniaku, atom azotu ma większą elektroujemność niż trzy atomy wodoru, co również prowadzi do powstania biegunów. Takie zjawiska są kluczowe dla zrozumienia, jak różne substancje reagują ze sobą oraz jakie mają właściwości chemiczne.
Jak powstają dipole? Zrozumienie podziału ładunków
Dipole powstają w wyniku nierównomiernego podziału ładunków w cząsteczkach. Kiedy atomy w cząsteczce mają różne poziomy elektroujemności, elektrony są przyciągane bliżej jednego z atomów, co prowadzi do powstania momentu dipolowego. Im większa różnica w elektroujemności, tym silniejszy dipol.
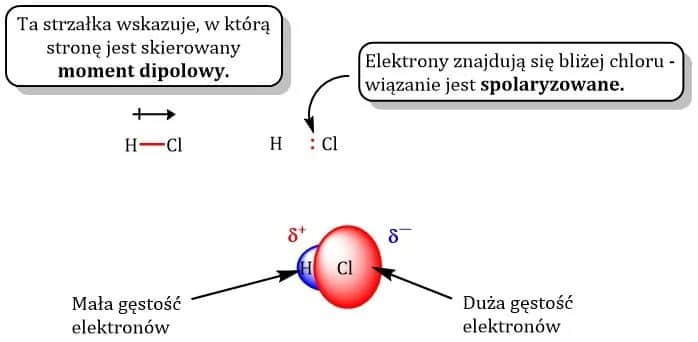
Na przykład, cząsteczka chlorowodoru (HCl) jest również dipolem. Atom chloru jest bardziej elektroujemny niż atom wodoru, co powoduje, że elektron jest przyciągany bliżej chloru. W rezultacie, chlor ma częściowy ładunek ujemny, a wodór częściowy ładunek dodatni. Taki mechanizm jest kluczowy dla zrozumienia, jak dipole wpływają na interakcje chemiczne i fizyczne substancji.
Dlaczego dipole są istotne w chemii? Ich rola w reakcji
Dipole odgrywają kluczową rolę w chemii, ponieważ wpływają na reakcje chemiczne oraz właściwości substancji. Dzięki obecności biegunów dodatnich i ujemnych, cząsteczki dipolowe mogą tworzyć różnorodne interakcje z innymi cząsteczkami. To zjawisko jest szczególnie ważne w kontekście rozpuszczalności i reakcji chemicznych.
Właściwości chemiczne dipoli są istotne dla zrozumienia, jak różne substancje oddziałują ze sobą. Na przykład, cząsteczki polarne, takie jak woda, mają zdolność do rozpuszczania wielu substancji, co czyni je kluczowymi w wielu procesach biologicznych i chemicznych. Zrozumienie tych aspektów pozwala na lepsze przewidywanie zachowań substancji w różnych warunkach.
Jak dipole wpływają na właściwości molekularne substancji?
Dipole mają znaczący wpływ na właściwości molekularne substancji, takie jak temperatura wrzenia, rozpuszczalność oraz gęstość. Na przykład, cząsteczki wody mają wysoką temperaturę wrzenia w porównaniu do innych substancji o podobnej masie cząsteczkowej, co jest wynikiem silnych oddziaływań dipolowych. Te interakcje pozwalają cząsteczkom wody przyciągać się nawzajem, co podnosi temperaturę wrzenia.
Również, rozpuszczalność substancji w wodzie jest ściśle związana z ich polarnością. Cząsteczki polarne, takie jak NaCl (sól kuchenna), łatwo rozpuszczają się w wodzie, ponieważ ich ładunki są przyciągane przez bieguny wody. Z kolei substancje niepolarne, takie jak olej, mają tendencję do nieodpowiedniego rozpuszczania się w wodzie, co prowadzi do powstawania dwóch oddzielnych warstw.
- Woda ma wysoką temperaturę wrzenia dzięki silnym oddziaływaniom dipolowym.
- Cząsteczki polarne łatwo rozpuszczają się w innych substancjach polarnych.
- Substancje niepolarne, takie jak olej, nie rozpuszczają się w wodzie.
Przykłady cząsteczek dipolowych i ich znaczenie chemiczne
W chemii istnieje wiele przykładów cząsteczek dipolowych, które mają istotne znaczenie dla różnych procesów. Oprócz wody, innymi popularnymi przykładami są amoniak (NH₃) oraz chlorowodorek (HCl). Amoniak jest cząsteczką polarności, która ma zdolność do tworzenia wiązań wodorowych, co jest kluczowe w wielu reakcjach biologicznych.
Chlorowodorek, będący również dipolem, jest znany z tego, że łatwo rozpuszcza się w wodzie, tworząc kwas solny. Te interakcje są niezwykle ważne w chemii, ponieważ wiele procesów zachodzi w roztworach wodnych, gdzie obecność dipoli wpływa na ich zachowanie. Zrozumienie tych cząsteczek pozwala na lepsze przewidywanie ich reakcji w różnych warunkach.
| Cząsteczka | Typ | Polarność |
| Woda (H₂O) | Dipol | Polar |
| Amoniak (NH₃) | Dipol | Polar |
| Chlorowodorek (HCl) | Dipol | Polar |
| Olej roślinny | Niepolarny | Niepolarny |
Czytaj więcej: Co to jest chemia i dlaczego warto ją zrozumieć w życiu codziennym
Jakie są konsekwencje dipoli w interakcjach chemicznych?

Dipole mają istotny wpływ na interakcje chemiczne, co jest kluczowe dla zrozumienia, jak różne substancje reagują ze sobą. Dzięki obecności momentu dipolowego, cząsteczki mogą tworzyć różnorodne oddziaływania, takie jak wiązania wodorowe czy siły Van der Waalsa. Te interakcje są niezbędne w wielu procesach chemicznych, od reakcji biologicznych po syntezę chemiczną.
Na przykład, woda, jako cząsteczka dipolowa, ma zdolność do tworzenia silnych wiązań wodorowych, co wpływa na jej właściwości fizyczne. To zjawisko jest kluczowe w biologii, gdzie woda pełni rolę rozpuszczalnika dla wielu reakcji chemicznych. Zrozumienie konsekwencji dipoli w interakcjach chemicznych pozwala lepiej przewidywać zachowanie substancji w różnych warunkach.
Wpływ dipoli na wiązania chemiczne i polarność
Dipole wpływają na właściwości chemiczne substancji poprzez kształtowanie wiązań chemicznych. Cząsteczki polarne, takie jak woda, mają zdolność do tworzenia wiązań wodorowych z innymi cząsteczkami, co jest kluczowe dla wielu procesów biologicznych. Na przykład, w białkach, struktura trzeciorzędowa jest stabilizowana przez te interakcje, co wpływa na ich funkcję.
Również, polarność cząsteczek ma znaczenie w kontekście ich reaktywności. Cząsteczki polarne często reagują z innymi substancjami w sposób bardziej efektywny niż cząsteczki niepolarne. Na przykład, reakcje chemiczne zachodzące w roztworach wodnych są często bardziej dynamiczne dzięki obecności dipoli, które ułatwiają interakcje między reagentami.
Jak dipole kształtują zachowanie substancji w różnych warunkach?
Dipole mają również znaczący wpływ na zachowanie substancji w różnych warunkach. Na przykład, w wysokich temperaturach, cząsteczki polarne mogą ulegać większym ruchom, co prowadzi do zmniejszenia siły oddziaływań między nimi. To zjawisko jest widoczne w przypadku wody, która w stanie gazowym (para wodna) ma znacznie mniejsze właściwości dipolowe niż w stanie ciekłym.
Dodatkowo, w różnych rozpuszczalnikach, cząsteczki dipolowe mogą zmieniać swoje zachowanie. Na przykład, w rozpuszczalnikach organicznych, które są niepolarne, cząsteczki polarne mogą mieć ograniczoną zdolność do interakcji. To wpływa na ich rozpuszczalność i reaktywność, co jest istotne w chemii analitycznej oraz syntezach chemicznych.
Rola dipoli w chemii: wpływ na reakcje i właściwości substancji
Dipole odgrywają kluczową rolę w chemii, wpływając na interakcje chemiczne oraz właściwości substancji. Przykład wody jako cząsteczki dipolowej pokazuje, jak obecność momentu dipolowego umożliwia tworzenie silnych wiązań wodorowych, co jest istotne w wielu procesach biologicznych. Właściwości polarności cząsteczek, takie jak zdolność do rozpuszczania innych substancji, mają bezpośrednie znaczenie dla reakcji chemicznych, co podkreśla ich znaczenie w zrozumieniu chemii.
W artykule omówiono również, jak dipole wpływają na wiązania chemiczne i polarność, co z kolei kształtuje zachowanie substancji w różnych warunkach. Na przykład, cząsteczki polarne, takie jak amoniak i chlorowodorek, wykazują różne właściwości w porównaniu do substancji niepolarnych, co jest kluczowe dla ich reaktywności. Zrozumienie tych zjawisk pozwala na lepsze przewidywanie zachowania substancji w różnych kontekstach chemicznych.