Obliczanie liczby atomów wodoru w amoniaku może wydawać się skomplikowane, ale zrozumienie kilku podstawowych zasad chemii sprawia, że staje się to proste. W tym artykule dowiesz się, jak obliczyć, ile atomów wodoru znajduje się w 5 molach amoniaku (NH₃), korzystając z podstawowych pojęć, takich jak mol i stała Avogadra.
Wiedza ta jest nie tylko przydatna w nauce chemii, ale także pomaga lepiej zrozumieć, jak działają reakcje chemiczne na poziomie molekularnym. Przedstawimy krok po kroku, jak przeprowadzić obliczenia, abyś mógł samodzielnie rozwiązać podobne problemy.
Kluczowe informacje:- W 5 molach amoniaku (NH₃) zawarte jest 9,03 * 1024 atomów wodoru.
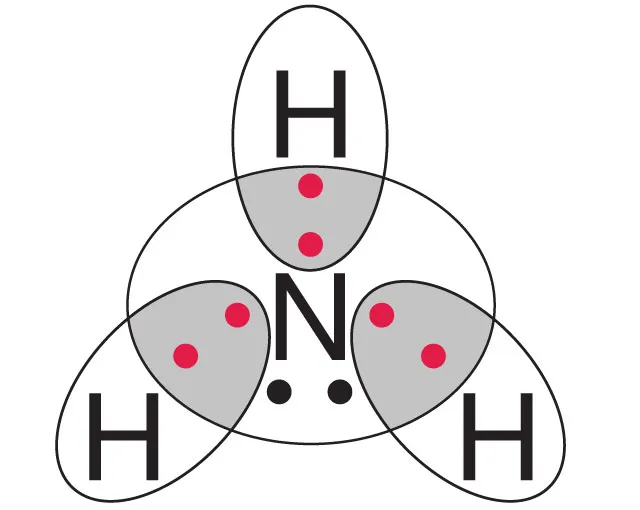
- Każda cząsteczka amoniaku składa się z 3 atomów wodoru i 1 atomu azotu.
- Do obliczeń wykorzystuje się stałą Avogadra, która wynosi 6,022 * 1023 cząsteczek na mol.
- Obliczenia stechiometryczne są kluczowe w chemii, aby określić ilości substancji w reakcjach.
- Proces obliczeniowy jest uniwersalny i może być stosowany do innych związków chemicznych.
Czym jest mol i dlaczego jest ważny w chemii?
Mol to podstawowa jednostka w chemii, która pozwala mierzyć ilość substancji. Jeden mol zawiera dokładnie 6,022 * 1023 cząsteczek, atomów lub jonów – tę liczbę nazywamy stałą Avogadra. Dzięki temu pojęciu chemicy mogą łatwo porównywać ilości różnych substancji w reakcjach.
W przypadku amoniaku (NH₃), mol pozwala określić, ile cząsteczek tej substancji znajduje się w danej próbce. To kluczowe, aby zrozumieć, ile atomów wodoru jest zawartych w 5 molach amoniaku. Bez znajomości mola obliczenia stechiometryczne byłyby znacznie trudniejsze.
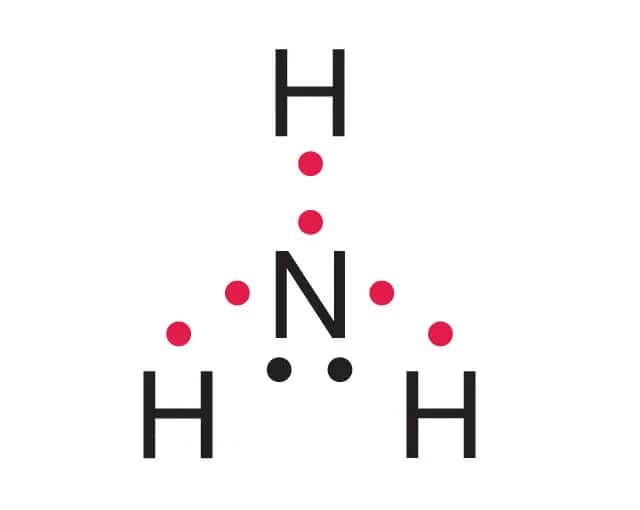
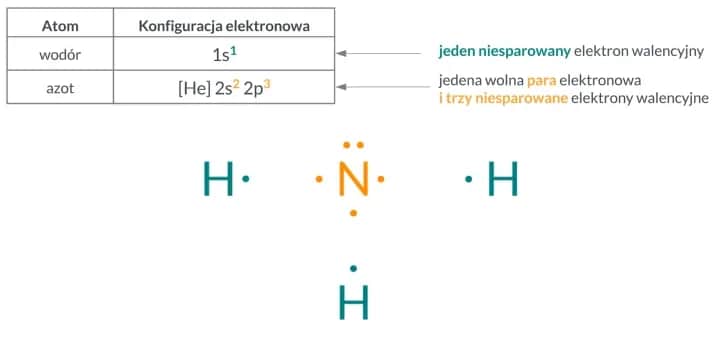
Struktura cząsteczki amoniaku i jej znaczenie
Cząsteczka amoniaku składa się z jednego atomu azotu (N) i trzech atomów wodoru (H). Ta prosta struktura chemiczna ma ogromne znaczenie w obliczeniach. Każda cząsteczka NH₃ zawiera 3 atomy wodoru, co jest kluczowe przy określaniu całkowitej liczby atomów w danej ilości moli.
Wiedza o strukturze amoniaku pozwala łatwo przejść od liczby moli do liczby atomów. Na przykład, jeśli masz 5 moli NH₃, możesz obliczyć, ile atomów wodoru się w nich znajduje. To właśnie dlatego zrozumienie budowy cząsteczki jest tak ważne w chemii.
Jak stała Avogadra pomaga w obliczeniach?
Stała Avogadra to liczba, która łączy świat mikroskopowy (atomy, cząsteczki) z makroskopowym (mole, gramy). Dzięki niej wiemy, że 1 mol dowolnej substancji zawiera 6,022 * 1023 cząsteczek. To narzędzie jest niezbędne w obliczeniach chemicznych.
W przypadku amoniaku, stała Avogadra pozwala przeliczyć mole na liczbę cząsteczek, a następnie na atomy wodoru. Na przykład, w 5 molach NH₃ znajduje się 9,03 * 1024 atomów wodoru. Bez tej stałej takie obliczenia byłyby niemożliwe.
| Liczba moli amoniaku | Liczba atomów wodoru |
| 1 mol | 1,806 * 1024 |
| 5 moli | 9,03 * 1024 |
Czytaj więcej: Jak kwitnie filodendron atom - kluczowe warunki i pielęgnacja
Krok po kroku: obliczanie atomów wodoru w 5 molach NH₃
Chcesz wiedzieć, ile atomów wodoru jest zawartych w 5 molach amoniaku? To prostsze, niż myślisz! Wystarczy znać strukturę cząsteczki NH₃ i stałą Avogadra. Każda cząsteczka amoniaku zawiera 3 atomy wodoru, co jest kluczem do rozwiązania problemu.
Najpierw oblicz liczbę cząsteczek amoniaku w 5 molach. Korzystając ze stałej Avogadra (6,022 * 1023 cząsteczek/mol), mnożysz 5 moli przez tę stałą. Następnie, ponieważ każda cząsteczka NH₃ ma 3 atomy wodoru, mnożysz wynik przez 3. To wszystko!
Ostatecznie, w 5 molach amoniaku znajduje się 9,03 * 1024 atomów wodoru. Takie obliczenia są nie tylko proste, ale także niezwykle przydatne w chemii.
Najczęstsze błędy w obliczeniach stechiometrycznych
Jednym z najczęstszych błędów jest pomylenie jednostek. Niektórzy zapominają, że stała Avogadra dotyczy liczby cząsteczek na mol, a nie atomów. To prowadzi do błędnych wyników, zwłaszcza w przypadku związków takich jak amoniak.Innym problemem jest nieuwzględnienie struktury cząsteczki. Na przykład, w NH₃ są 3 atomy wodoru na cząsteczkę, ale niektórzy pomijają ten fakt. Pamiętaj, aby zawsze sprawdzać, ile atomów danego pierwiastka znajduje się w jednej cząsteczce.
Praktyczne zastosowanie obliczeń w chemii
Obliczenia stechiometryczne, takie jak te dla amoniaku, są niezbędne w laboratoriach i przemyśle. Na przykład, produkcja nawozów sztucznych wymaga precyzyjnego określenia ilości amoniaku i jego składników. Bez tych obliczeń procesy chemiczne byłyby chaotyczne.
Ponadto, wiedza o tym, ile atomów wodoru jest zawartych w 5 molach amoniaku, pomaga w projektowaniu reakcji chemicznych. To kluczowe dla optymalizacji procesów i minimalizacji odpadów.
- Oblicz liczbę cząsteczek amoniaku w 5 molach, mnożąc przez stałą Avogadra.
- Pomnóż wynik przez 3, ponieważ każda cząsteczka NH₃ zawiera 3 atomy wodoru.
- Sprawdź jednostki, aby upewnić się, że wynik jest poprawny.
Dlaczego obliczenia stechiometryczne są kluczem do chemii?
W artykule pokazaliśmy, jak obliczenia stechiometryczne pozwalają określić dokładną liczbę atomów wodoru w 5 molach amoniaku. Dzięki stałej Avogadra i znajomości struktury cząsteczki NH₃, możemy łatwo przejść od moli do atomów, co jest niezbędne w wielu zastosowaniach chemicznych.
Przykład amoniaku ilustruje, jak ważne jest unikanie błędów, takich jak pomylenie jednostek czy nieuwzględnienie struktury cząsteczki. Te błędy mogą prowadzić do nieprawidłowych wyników, dlatego zawsze warto sprawdzać jednostki i strukturę związku przed przystąpieniem do obliczeń.Praktyczne zastosowanie tych obliczeń, np. w produkcji nawozów sztucznych, pokazuje, że są one nie tylko teoretycznym narzędziem, ale także kluczem do efektywnych procesów chemicznych. Dzięki nim możemy optymalizować reakcje i minimalizować odpady, co ma ogromne znaczenie w przemyśle i badaniach naukowych.