Czy kiedykolwiek zastanawiałeś się, skąd bierze się ładunek elektryczny w atomach, które tworzą cząsteczki wokół nas? Ten artykuł przeprowadzi Cię krok po kroku przez proces powstawania jonów z obojętnych atomów. Dowiesz się, dlaczego atomy tracą lub zyskują elektrony i jak łatwo obliczyć ładunek powstałego w ten sposób jonu.
Ładunek jonu jak prosto obliczyć, ile elektronów atom stracił lub zyskał
- Atom w stanie podstawowym jest elektrycznie obojętny, posiadając równą liczbę protonów i elektronów.
- Jon to atom, który zyskał ładunek elektryczny poprzez utratę lub przyjęcie elektronów.
- Utrata elektronów prowadzi do powstania jonu dodatniego (kationu), a jego ładunek odpowiada liczbie utraconych elektronów.
- Przyjęcie elektronów skutkuje powstaniem jonu ujemnego (anionu), a jego ładunek odpowiada liczbie przyjętych elektronów.
- Atomy dążą do stabilności (reguła oktetu lub dubletu), co jest główną przyczyną tworzenia jonów.
- Ładunek jonu zapisuje się w prawym górnym indeksie symbolu pierwiastka (np. Na⁺, O²⁻).

Jak atom zyskuje ładunek? Poznaj podstawy
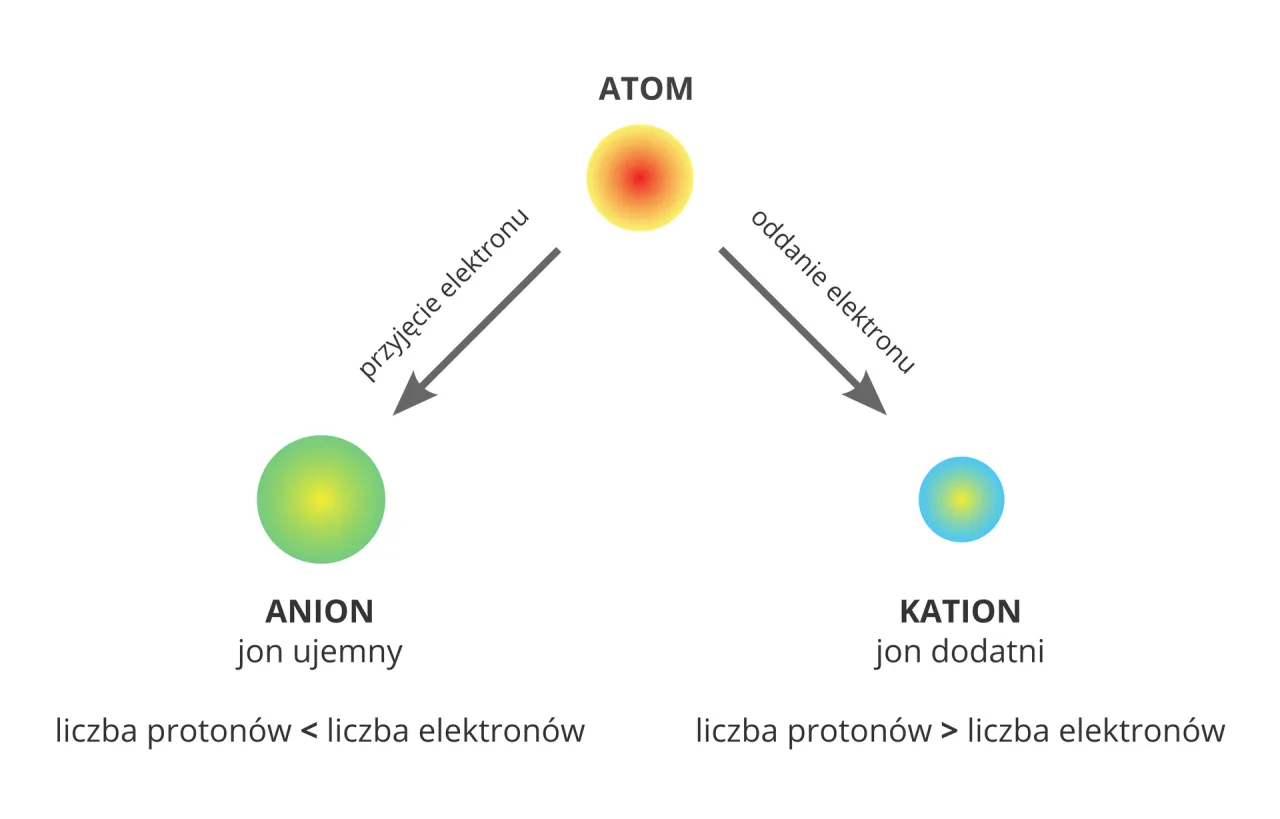
Każdy atom w swoim naturalnym, podstawowym stanie jest elektrycznie obojętny. Dzieje się tak dlatego, że liczba jego dodatnio naładowanych protonów, znajdujących się w jądrze, jest dokładnie taka sama jak liczba ujemnie naładowanych elektronów krążących wokół tego jądra. Ta idealna równowaga sprawia, że atom jako całość nie wykazuje ani dodatniego, ani ujemnego ładunku.
Jednak atomy nie zawsze pozostają w tym stabilnym stanie. Główną siłą napędową do zmiany jest ich nieustanne dążenie do osiągnięcia trwałej konfiguracji elektronowej, podobnej do tej, którą posiadają gazy szlachetne. Zazwyczaj oznacza to posiadanie ośmiu elektronów na swojej zewnętrznej powłoce (tzw. reguła oktetu) lub dwóch elektronów w przypadku najlżejszych pierwiastków (reguła dubletu). Aby osiągnąć ten upragniony stan stabilności, atomy są skłonne do oddawania lub przyjmowania elektronów.
Atom traci elektrony jak powstaje jon dodatni?
Kiedy obojętny atom decyduje się na pozbycie się jednego lub więcej swoich elektronów walencyjnych, zachodzi fascynująca przemiana. W wyniku tej utraty elektronów, liczba dodatnio naładowanych protonów w jądrze staje się większa niż liczba ujemnie naładowanych elektronów krążących na powłokach. Powstaje wtedy cząstka o nazwie kation, która posiada wypadkowy ładunek dodatni.
Obliczenie ładunku dodatniego kationu jest niezwykle proste. Wartość tego ładunku jest zawsze równa dokładnie tej liczbie elektronów, które atom utracił. Im więcej elektronów atom odda, tym wyższy będzie jego dodatni ładunek.
Przykładem może być sód (Na). Atom sodu posiada jeden elektron na swojej zewnętrznej powłoce. Dążąc do stabilności, łatwo pozbywa się tego jednego elektronu. W rezultacie, atom sodu przekształca się w jon sodu o ładunku dodatnim.
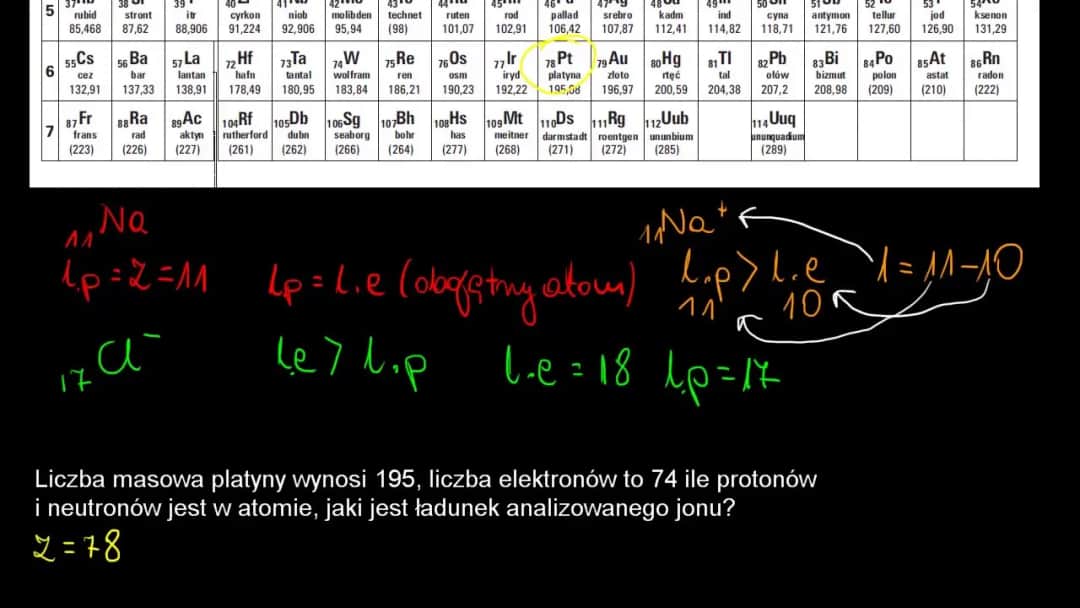
- Atom sodu (Na) posiada 11 protonów i 11 elektronów. Jest obojętny.
- Atom sodu traci swój jeden elektron walencyjny, aby uzyskać stabilną konfigurację.
- Pozostaje 11 protonów i 10 elektronów.
- Powstaje jon sodu (Na⁺) o ładunku +1.
W tym procesie atom sodu, tracąc jeden elektron, zyskuje ładunek dodatni równy jeden. Zapisujemy go jako Na⁺.
Przyjrzyjmy się teraz magnezowi (Mg). Atom magnezu ma dwa elektrony na swojej ostatniej powłoce. Aby osiągnąć stabilność, magnez pozbywa się obu tych elektronów.
- Atom magnezu (Mg) posiada 12 protonów i 12 elektronów. Jest obojętny.
- Atom magnezu traci swoje dwa elektrony walencyjne.
- Pozostaje 12 protonów i 10 elektronów.
- Powstaje jon magnezu (Mg²⁺) o ładunku +2.
W tym przypadku magnez, tracąc dwa elektrony, staje się jonem o dwukrotnie większym ładunku dodatnim, co zapisujemy jako Mg²⁺.
Atom przyjmuje elektrony jak powstaje jon ujemny?
Zupełnie odwrotna sytuacja ma miejsce, gdy atom decyduje się na przyjęcie elektronów. Kiedy obojętny atom "zabiera" jeden lub więcej elektronów ze swojego otoczenia, liczba ujemnie naładowanych elektronów na jego powłokach staje się większa niż liczba dodatnio naładowanych protonów w jądrze. W ten sposób powstaje anion jon o wypadkowym ładunku ujemnym.
Obliczanie ładunku ujemnego jest równie intuicyjne. Wartość ładunku anionu jest równa liczbie elektronów, które atom przyjął. Im więcej elektronów atom zyska, tym silniejszy będzie jego ładunek ujemny.
Weźmy pod lupę chlor (Cl). Atom chloru ma siedem elektronów na swojej zewnętrznej powłoce i bardzo pragnie uzupełnić ją do ośmiu. Dlatego łatwo przyjmuje jeden dodatkowy elektron.
- Atom chloru (Cl) posiada 17 protonów i 17 elektronów. Jest obojętny.
- Atom chloru przyjmuje jeden elektron, aby uzyskać stabilną konfigurację.
- Teraz ma 17 protonów i 18 elektronów.
- Powstaje jon chlorkowy (Cl⁻) o ładunku -1.
Chlor, przyjmując jeden elektron, staje się anionem o ładunku -1, co zapisujemy jako Cl⁻.
A jak wygląda sytuacja z tlenem (O)? Atom tlenu ma sześć elektronów walencyjnych i potrzebuje dwóch, aby osiągnąć oktet. Dlatego przyjmuje dwa elektrony.
- Atom tlenu (O) posiada 8 protonów i 8 elektronów. Jest obojętny.
- Atom tlenu przyjmuje dwa elektrony, aby uzyskać stabilną konfigurację.
- Teraz ma 8 protonów i 10 elektronów.
- Powstaje jon tlenkowy (O²⁻) o ładunku -2.
Tlen, przyjmując dwa elektrony, tworzy jon tlenkowy o ładunku -2, zapisywany jako O²⁻.
Uniwersalna metoda obliczania ładunku jonu
Niezależnie od tego, czy atom traci, czy zyskuje elektrony, istnieje jedna uniwersalna zasada, która pozwala obliczyć ładunek powstałego jonu. Jest to prosta matematyka oparta na bilansie protonów i elektronów. Ładunek jonu zawsze można określić jako różnicę między liczbą protonów (ładunek dodatni) a liczbą elektronów (ładunek ujemny) po tym, jak atom przeszedł przemianę. Wzór jest następujący: Ładunek = liczba protonów - liczba elektronów po zmianie.
Prawidłowe zapisanie symbolu jonu wraz z jego ładunkiem jest równie ważne. Ładunek ten umieszcza się w prawym górnym indeksie symbolu pierwiastka. Jeśli ładunek jest dodatni, najpierw piszemy cyfrę, a potem znak plus (np. Ca²⁺). Jeśli ładunek jest ujemny, piszemy najpierw cyfrę, a potem znak minus (np. F⁻). Warto pamiętać, że jeśli ładunek wynosi 1 (dodatni lub ujemny), cyfrę "1" zazwyczaj pomija się, pisząc po prostu znak plus lub minus (np. Cl⁻ zamiast Cl¹⁻, czy Na⁺ zamiast Na¹⁺). Dla jonów z ładunkiem większym niż 2, jak na przykład Al³⁺, zapisujemy pełny ładunek.
- Ca²⁺ (jon wapnia)
- F⁻ (jon fluorkowy)
- Al³⁺ (jon glinowy)
Zapamiętaj najważniejsze zasady tworzenia jonów
Podsumowując, oto kluczowe zasady dotyczące powstawania i obliczania ładunku jonu, które warto mieć zawsze na uwadze:
- Utrata elektronów = ładunek dodatni (+)
- Przyjęcie elektronów = ładunek ujemny (-)
- Wartość ładunku zawsze odpowiada liczbie "przeniesionych" elektronów
Przeczytaj również: Tłuszcze w chemii: Co to są, ich rodzaje i znaczenie dla zdrowia
Twoje nowe umiejętności: Jak łatwo określić ładunek jonu
Gratulacje! Teraz wiesz już, jak obojętny atom staje się jonem i jak prosto obliczyć jego ładunek. Przeszliśmy przez podstawy budowy atomu, zrozumiałe zasady powstawania kationów i anionów, a także poznaliśmy praktyczne przykłady, które rozwieją wszelkie wątpliwości.
- Atom jest obojętny, gdy liczba protonów równa się liczbie elektronów.
- Utrata elektronów tworzy jon dodatni (kation), a jego ładunek jest równy liczbie utraconych elektronów.
- Przyjęcie elektronów tworzy jon ujemny (anion), a jego ładunek jest równy liczbie przyjętych elektronów.
- Kluczem do stabilności jest dążenie atomów do uzyskania konfiguracji gazu szlachetnego.
Z mojego doświadczenia wynika, że zrozumienie tej podstawowej zasady różnicy między liczbą protonów a elektronów jest kluczem do dalszej nauki chemii. Pamiętaj, że każdy atom dąży do równowagi, a tworzenie jonów to po prostu jeden ze sposobów na jej osiągnięcie. Nie zniechęcaj się, jeśli na początku wydaje się to skomplikowane; praktyka czyni mistrza!
A jakie są Twoje doświadczenia z obliczaniem ładunków jonów? Czy któryś z przykładów szczególnie Ci pomógł? Podziel się swoimi przemyśleniami w komentarzach poniżej!